
3.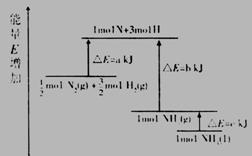 化學反應N2+3H2=2NH3的能量變化如圖所示,該反應的熱化學方程式是(
)
化學反應N2+3H2=2NH3的能量變化如圖所示,該反應的熱化學方程式是(
)
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C.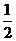 N2(g)+
N2(g)+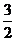 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
D. 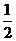 N2(g)+
N2(g)+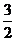 H2(g)=NH3(g); △H=(a+b)kJ·mol-1
H2(g)=NH3(g); △H=(a+b)kJ·mol-1
2.白磷與氧可發生如下反應:P4+5O2=P4O10。已知斷裂下列化學鍵需要吸收的能量分別為:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
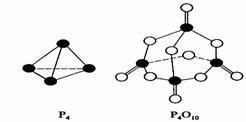
根據圖示的分子結構和有關數據估算該反應的△H,其中正確的是 ( )
A.(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
|
化學鍵 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
鍵能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
[例6]
則反應SiCl4(g)+2H2(g) Si(s)+4HCl(g)△H= kJ/mol
Si(s)+4HCl(g)△H= kJ/mol
[例7]煉鐵時可能發生如下反應:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1 (2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2
(3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3 (4) FeO(s)+ CO(g)= Fe(s)+ CO2(g) △H4
則△H4與 △H1、△H2 △H3的關系是
[鞏固練習]
1.下列關于熱化學反應的描述中正確的是 ( )
A.反應是放熱還是吸熱必須看反應物和生成物所具有的總能量的相對大小。
B.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)===2CO(g)+O2(g)反應的△H=2×283.0kJ/mol
C.需要加熱才能發生的反應一定是吸熱反應
D.1mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱
定義:在101kp下, 物質完全燃燒生成 的氧化物時所放出的熱量。
[說明]⑴燃燒熱是以1mol物質完全燃燒所放出的熱量來定義的,因此在書寫燃燒熱熱化方程時,一般以燃燒1mol物質為標準來配平其余物質。
⑵燃燒產物必須是穩定的氧化物。例: :C-- ,H-- ,S-- ,N-- 。
[例4]已知標準狀況下,1升H2S氣體完全燃燒生成液態水時放出a kJ的熱量,請寫出硫化氫燃燒熱的熱化學方程式: 。
[例5]下列說法或表示法正確的是 ( )
A.等量的白磷蒸氣和白磷固體分別完全燃燒,后者放出熱量多
B.由C(石墨)→C(金剛石);ΔH = +1.19 kJ· mol-1可知,金剛石比石墨穩定
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量大于57.3 kJ
D.在101 kPa時,2g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol-1
有:△H1=△H2+△H3+△H4 應用:計算無法直接實驗測量的反應的反應熱。
[例3]已知下列反應的反應熱為:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2= -393.5KJ/mol
(3) H2(g)+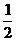 O2(g)=H2O(l) △H3= -285.8KJ/mol
O2(g)=H2O(l) △H3= -285.8KJ/mol
試計算下列反應的反應熱: 2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=
2.熱化學方程式的書寫
注意點:①要注明物質狀態:②ΔH數值與方程式中化學計量數有關:③ΔH=±x kJ/mol
[例1]下列熱化學方程式書寫正確的是( )
A、C(s)+O2(g)==CO2(g);△H=+393.5kJ/mol
B、2SO2+O2==2SO3;△H= -196.6kJ/mol
C、H2(g)+1/2O2(g)==H2O(l);△H= -285.8kJ/mol
D、2H2(g)+O2(g)==2H2O(l);△H= -571.6KJ
[例2]由氫氣和氧氣反應生成1mol水蒸氣放熱241.8kJ寫出該反應的熱化學方程式:
。若1g水蒸氣轉化為液態水放熱2.44kJ,則反應H2(g)+1/2O2(g)=H2O(l)的△H= kJ/mol,氫氣的燃燒熱為 kJ/mol。
1.定義:表明反應所放出或吸收的熱量的化學方程式,叫做熱化學方程式。
2.規定:△H = - Q KJ/ mol < 0則為 反應;
△H = + Q KJ/ mol > 0則為 反應;
注意:在書寫反應熱△H的數值時,性質符號“+”或“-”不能省略。
1.定義:化學反應過程中吸收或放出的熱量,叫做反應熱。用 表示,單位為 。
4、能量變化的原因
⑴從化學鍵角度看(主要原因):
新鍵生成釋放的能量 舊鍵斷裂吸收的能量,則反應放熱。
新鍵生成釋放的能量 舊鍵斷裂吸收的能量,則反應吸熱。
⑵從物質本身能量看:
反應物總能量 生成物總能量,反應放熱。
反應物總能量 生成物總能量,反應吸熱。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com