
2. 實驗室制備硝基苯的主要步驟如下:
實驗室制備硝基苯的主要步驟如下:
①配制一定比例的濃H2SO4與濃HNO3的混合酸,加入反應器中;
②向室溫下的混合酸中逐滴加入一定量的苯,充分振蕩,混合均勻;
③在50-60℃下發生反應,直至反應結束;
④除去混合酸后,粗產品依次用蒸餾水和5% NaOH溶液洗滌,
最后再用蒸餾水洗滌;
⑤將用無水CaCl2干燥后的粗硝基苯進行蒸餾,得到純凈硝基苯。
請填寫下列空白:
(1)配制一定比例濃H2SO4與濃HNO3混合酸時,為什么要把濃硫酸慢慢注入濃硝酸中?
。
(2)步驟③中,為了使反應在50-60℃下進行,常用的方法是 ;
為什么硝化反應要控制在50℃-60℃? ;
溫度計的作用及其水銀球的位置如何? 。
(3)裝置中常在試管上連接玻璃管,作用是什么? 。
(4)步驟④中洗滌、分離粗硝基苯應使用的儀器是 。
(5)步驟④中粗產品用5% NaOH溶液洗滌的目的是 。
(6)純硝基苯是無色,密度比水 (填大或小),具有 氣味的油狀液體。
1.下圖中A是制取溴苯的實驗裝置,B、C是改進后的裝置。請仔細分析,對比三個裝置,回答以下問題:
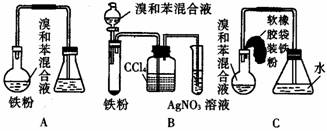
(1)寫出三個裝置中所共同發生的兩個反應的化學方程式:
` 。
寫出B的試管中所發生反應的化學方程式 。
(2)裝置A和C均采用了長玻璃導管,其作用是 。
(3)在按裝置B、C裝好儀器及藥品后要使反應開始,應對裝置B進行的操作是
;應對裝置C進行的操作是 。
(4)裝置B、C較好地解決了A中加裝藥品和使裝置及時密封的矛盾,方便了操作。A裝置中這一問題在實驗中造成的后果是 。
(5)B中采用了洗氣瓶吸收裝置,其作用是 ,反應后洗氣瓶中可能出現的現象是 。
(6)B裝置也存在兩個明顯的缺點,使實驗的效果不好或不能正常進行。這兩個缺點是:
。
9.煤中含有硫,燃燒時會產生有害的SO2,用生石灰可以消除SO2,減少污染,其反應為
CaO(s)+SO2(s) == CaSO3(s)
298 K、1.01×1.01×105Pa時,此反應的△H== -402.0 kJ·mol-1,∆S== 345.7 J·mol-1·K-1,在室溫下自發進行。則保持此反應自發進行的最高爐溫是多少(焓變△H及熵變∆S受溫度的影響可忽略)?
8.某化學反應其△H== -122 kJ·mol-1,∆S== 231 J·mol-1·K-1,則此反應在下列哪種情況下可自發進行 ( )
A.在任何溫度下都能自發進行 B.在任何溫度下都不能自發進行
C.僅在高溫下自發進行 D.僅在低溫下自發進行
7.已知:298 K、1.01×105Pa下:
石墨:△H===0.0 kJ·mol-1、S== 5.74 J·mol-1·K-1;
金剛石:△H== 1.88 kJ·mol-1、S== 2.39 J·mol-1·K-1。
下列敘述中,正確的是 ( )
A.根據焓和熵的觀點,石墨比金剛石穩定
B.根據焓和熵的觀點,金剛石比石墨穩定
C.根據熵的觀點,石墨比金剛石穩定,但根據焓的觀點,金剛石比石墨穩定
D.根據焓的觀點,石墨比金剛石穩定,但根據熵的觀點,金剛石比石墨穩定
6.在25℃、1.01×105 Pa條件下,反應2N2O5(g)== 4NO2(g)+O2(g) ∆H== +56.7 kJ· mol-1能夠自發進行。從能量上分析,生成物的總能量比反應物的總能量 ,從反應前后的熵值看,反應后的熵值 (填“增加”、“減小”或“不變”)。
[提高題]
5.下列熱化學方程式中,放出的熱量最多的是 ( )
A.CH4 (g)+2O2 (g) == CO2 (g)+2H2O (1) △H
B.2CH4 (g)+4O2 (g) == 2CO2 (g)+4H2O (1) △H
C.CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) △H
D.2CH4 (g)+4O2 (g) == 2CO2 (g)+4H2O (g) △H
4.已知反應2H2 (g) + O2 (g) == 2H2O (1) ∆H == 285.8 kJ·mol-1,下列結論中,正確的是 ( )
A.E(反應物)>E(生成物) B.E(反應物)<E(生成物)
C.反應放熱 D.反應吸熱
3.水在273 K、1.01×105Pa時可轉化為固態,在373 K時則又可轉化為氣態。若分別用S(g)、S(1)、S(s)表示水的氣、液、固三種狀態的熵值,則下列表達式中,正確的是 ( )
A.S(g)<S(1)<S(s) B.S(g)>S(1)>S(s)
C.S(g)>S(1)= S(s) D.S(g)>S(s)>S(1)
2.下列物質中,熵值(S)最大的是 ( )
A.金剛石 B.Cl2(1) C.I2(g) D.Cu(s)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com