
9、同分異構體:分子式相同結構式不同的化合物互稱
 C4H10 CH3CH2CH2CH3 CH3CHCH3 異丁烷
C4H10 CH3CH2CH2CH3 CH3CHCH3 異丁烷
正丁烷 CH3 CH3


 C5H12 CH3CH2CH2
CH2 CH3 CH3CHCH2
CH2 CH3C CH3
C5H12 CH3CH2CH2
CH2 CH3 CH3CHCH2
CH2 CH3C CH3
戊烷 CH3 CH3
2-甲基丁烷 2,2-二甲基丙烷
專題六 化學反應與能量
第一單元 反應速率與反應限度
8、碳最外層四個電子,一個碳原子可以形成四個共價鍵,可以構成C-C、C=C、C≡C
7、電子式
(1)寫出下列物質的電子式:H2 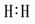 Cl2
Cl2 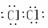 N2
N2  HCl
HCl 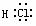 H2O
H2O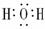 CO2
CO2 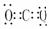 NH3
NH3 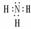 CH4
CH4 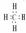 NaCl
NaCl
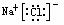 MgCl2
MgCl2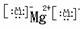 NaOH Na+
NaOH Na+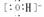
用電子式表示下列物質的形成過程:
(1) HCl : (2)NaCl:
6、化學鍵:物質中直接相鄰的原子或離子之間強烈的相互作用
|
離子化合物:陰、陽離子通過靜電作用相成的化合物
離子鍵:活潑的金屬 活潑的非金屬
(2) 共價鍵:原子之間通過共用電子對所形成的強烈的相互作用
共價化合物:通過共用電子對所形成的化合物
非極性鍵:相同的非金屬元素之間 極性鍵 不同的非金屬元素之間
5、 元素周期表 短周期 1、2、3
元素周期表 短周期 1、2、3
 周期 長周期4、5、6
周期 長周期4、5、6
(1)結構 不完全周期7
 主族 ⅠA-ⅦA
主族 ⅠA-ⅦA
族 副族ⅠB-ⅦB
第Ⅷ族 8、9、10 0族 惰性氣體
(2)周期序數 = 電子層數 主族序數 = 原子最外層電子數
(3)每一周期從左向右,原子半徑逐漸 減小;主要化合價從 +1- +7(F、O無正價),金屬性逐漸減弱,非金屬性逐漸增強。
每一主族從上到下右,原子半徑逐漸增大 ;金屬性逐漸增強 ,非金屬性逐漸減弱。
4、元素周期律:元素的性質隨著原子核電荷數的遞增而呈現周期性變化的規律
元素周期律是元素核外電子排布隨元素核電荷數的遞增的必然結果
(1) 隨著原子核電荷數的遞增原子的最外層電子電子排布呈現周期性變化
除1、2號元素外,最外層電子層上的電子重復出現1遞增8的變化
(2)隨著原子核電荷數的遞增原子半徑呈現周期性變化
同周期元素,從左到右,原子半徑 減小 ,如:Na Mg Al Si P S Cl;C N O F
(3)隨著原子核電荷數的遞增元素的主要化合價呈現周期性變化
同周期最高正化合價從左到右逐漸增加,最低負價的絕對值逐漸減小
元素的最高正化合價==原子的 最外層電子數 ;最高正化合價與負化合價的絕對值之和= 8 。
(4)隨著原子核電荷數的遞增元素的金屬性和非金屬性呈現周期性變化
同周期,從左到右 元素的金屬性逐漸減弱,元素的非金屬性逐漸增強
Na Mg Al Si P S Cl 金屬性:Na>Mg>Al
金屬性逐漸減弱 非金屬性逐漸增強
非金屬性:Cl>S>P>Si,
非金屬性逐漸增強
非金屬性:Cl>S>P>Si,
(5)①元素的金屬性越強,最高價氧化物對應的水化物(氫氧化物)堿性越 強,反之也如此。金屬性:Na>Mg>Al,氫氧化物堿性強弱為NaOH > Mg(OH)2> Al(OH)3。
②元素的非金屬性越強,最高價氧化物對應的水化物(含氧酸)酸性越 強 ,反之也如此。
非金屬性:Si <P< S< Cl,H3PO4是 弱 酸,H2SO4是 強 酸, HClO4是最強酸;H3PO4 <H2SO4< HClO4;元素的非金屬性越強,形成的氫化物越 穩定;氫化物的穩定性為SiH4<PH3<H2S<HCl
3、1-18號元素的原子結構示意圖 P書2
2.核外電子排布規律:
① 最外層最多只能容納8個電子(氦原子是 2 個);② 次外層最多只能容納 18 個電子;
③ 倒數第三層最多只能容納 32 個電子;④ 每個電子層最多只能容納 2n2 個電子。
另外,電子總是盡先排布在能量最低的電子層里;
1、元素:含有相同質子數同一類原子總稱。 核素:含有一定數目質子與中子的原子
同位素:含有同質子數不同中子數的同一種元素的不同原子互稱
質量數:質子數與中子數之和
4、硝酸的制備與性質 ★NH4+ 檢驗:加入NaOH加熱產生的氣體能使濕潤的紅色石蕊試紙變藍
工業制取:(1)氨在催化劑的作用下與氧氣發生反應,生成NO
4NH3 + 5O2 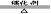 4 NO+6 H2O
4 NO+6 H2O
(2)NO與氧氣反應生成NO2 2NO+O2=== 2NO2
(3)用水吸收NO2生成硝酸 3NO2 + H2O = 2HNO3+NO
性質:Cu + 4HNO3(濃)=== Cu(NO3)2+2NO2↑+2H2O 3Cu + 8HNO3(稀)==Cu(NO3)2+2NO↑+4H2O
C+ 4HNO3(濃)=== CO2↑+2NO2↑+2H2O

 常溫下,濃硫酸使鐵鋁鈍化
常溫下,濃硫酸使鐵鋁鈍化
|
|
|
|
|


|



 化學2
化學2
專題五微觀結構與物質的多樣性
第一單元核外電子排布
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com