
14.常溫下,下列各溶液的敘述中正確的是
A.0.1mol/L的醋酸鈉溶液20mL與0.1mol/L鹽酸10mL混合后溶液顯酸性
c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
B.pH=7的醋酸鈉和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,則a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF與CH3COOK溶液中,
[c(Na+)-c(F-)]< [c(K+)-c(CH3COO-)]

第II卷(非選擇題 共72分)
13.某密閉密閉容器中進行如下反應(yīng):X(g)+2Y(g) 2Z(g),若要使平衡時反應(yīng)物總物質(zhì)的量與生成物的物質(zhì)的量相等,且用X、Y作反應(yīng)物,則X、Y的初始物質(zhì)的量之比的范圍應(yīng)滿足
2Z(g),若要使平衡時反應(yīng)物總物質(zhì)的量與生成物的物質(zhì)的量相等,且用X、Y作反應(yīng)物,則X、Y的初始物質(zhì)的量之比的范圍應(yīng)滿足
A.1<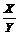 <3 B.
<3 B.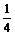 <
<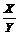 <
<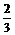 C.3<
C.3<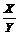 <4 D.
<4 D.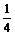 <
<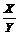 <
<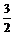

12.銀鋅紐扣電池由鋅粉作負極、氧化銀作正極和氫氧化鉀溶液構(gòu)成。電池工作時的反應(yīng)原理為:Zn+Ag2O+H2O=Zn(OH)2+2Ag。則下列說法正確的是
A.電池工作時,負極附近溶液的pH減小
B.電池工作時,溶液中OH—向正極移動
C.電池工作一段時間后,溶液的pH不變
D.電池工作過程中,Ag2O發(fā)生還原反應(yīng)
11.工業(yè)制硝酸的其中一步反應(yīng)為氨的氧化,反應(yīng)方程式為:
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) △H=-1025 kJ/mol
4NO(g) + 6H2O(g) △H=-1025 kJ/mol
氧化過程中還伴隨有N2O、N2等物質(zhì)生成。有關(guān)該反應(yīng)的說法正確的是
A.反應(yīng)處于平衡狀態(tài)時,c(NH3)·c(O2)=c(NO)·c(H2O)
B.反應(yīng)達到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它條件不變,溫度越高,氨的轉(zhuǎn)化率越高
D.尋找合適的催化劑是加快反應(yīng)速率并提高NO產(chǎn)率的有效措施
10.在一定條件下,反應(yīng)xA + yB zC △H達到平衡狀態(tài),下列說法不正確的是
zC △H達到平衡狀態(tài),下列說法不正確的是
A.若A、B、C都是氣體,在減壓后平衡向逆反應(yīng)方向移動,則x+y>z
B.若C是氣體,且x+y=z,增大壓強時,平衡發(fā)生移動,則平衡向正反應(yīng)方向移動
C.若B、C是氣體,其他條件不變,增大A的量,平衡不移動,則A不是氣態(tài)物質(zhì)
D.若加熱后C的質(zhì)量分?jǐn)?shù)減少,則該反應(yīng)的焓變△H>0
9.下列各組離子,在指定的環(huán)境中能大量共存的是
A.在酸性溶液中:Na+、K+、MnO4—、S2O32—
B.在中性溶液中:Al3+、K+、SO42—、HCO3—
C.25℃,pH=0的溶液中:Al3+、NH4+、NO3—、Fe2+
D.c(H+)<c(OH—)的溶液中:Na+、K+、SO42—、NO3—
8.下列實驗操作能達到實驗?zāi)康牡氖?img src="http://thumb.zyjl.cn/pic4/img3/down2010/19/252664/1010jiajiao.files/image002.jpg">
|
編號 |
實驗?zāi)康?br> |
實驗操作 |
|
A |
測定溶液的pH值 |
用廣泛pH試紙測得溶液的pH為2.3 |
|
B |
證明氯化鐵與碘化鉀溶液發(fā)生氧化還原反應(yīng) |
將兩根用導(dǎo)線相連的鐵棒分別插入用鹽橋相連的氯化鐵、碘化鉀溶液中 |
|
C |
排除堿式滴定管尖嘴部分的氣泡 |
將膠管彎曲使玻璃尖嘴斜向上,用兩指捏住膠管,輕輕擠壓玻璃珠,使溶液從尖嘴流出 |
|
D |
準(zhǔn)確測定體積25 mL濃度約為0.15mol·L-1HCl溶液的濃度 |
用25.00 mL堿式滴定管和0.1000mol·L-1 NaOH溶液滴定 |
7.在周期表主族元素中,甲元素與乙、丙、丁三元素緊密相鄰。甲、丁的原子序數(shù)之和等于丙的原子序數(shù);這四種元素原子的價電子數(shù)之和為20,下列判斷中正確的是
 A.原子半徑:丙>丁>甲>乙
A.原子半徑:丙>丁>甲>乙
B.甲、乙、丙三種元素位于周期表的同一周期
C.最高價氧化物對應(yīng)水化物的酸性:乙>甲
D.氣態(tài)氫化物的穩(wěn)定性:甲>丙
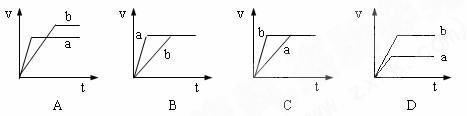
6.將等質(zhì)量且過量的兩份鋅粉a、b中分別加入相同體積、相同物質(zhì)的量濃度的稀硫酸,同時向a中加入少量硫酸銅溶液,下列各圖產(chǎn)生H2的體積V(L)與時間t(min)的關(guān)系中正確的是

5.X、Y、Z、M是4種短周期元素,其中X、Y位于同一主族,Y與M、X與Z位于同一周期。X原子最外層電子數(shù)是其電子層數(shù)的3倍。Z原子的核外電子數(shù)比X原子少1。M是同周期中原子半徑最大的元素(除稀有氣體元素)。下列說法正確的是
A.Y元素最高價氧化物對應(yīng)水化物的化學(xué)式可表示為HYO3
B.Z和M組成的化合物為離子化合物,它與鹽酸反應(yīng)可以生成兩種鹽
C.X、Y、Z元素的氣態(tài)氫化物中,Y的沸點最高
D.四種元素簡單離子的半徑由大到小依次為Y>M>X>Z
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com