
4.(2007海南·)下列敘述正確的是( )
A.95℃純水的pH<7,說明加熱可導致水呈酸性
B.pH=3的醋酸溶液,稀釋至10倍后pH=4
C.0.2mol/L的鹽酸,與等體積水混合后pH=1
D.pH=3的醋酸溶液,與pH=11的氫氧化鈉溶液等體積混合后pH=7
答案:C
考點:本題考查了電離平衡移動以及酸堿中和后溶液pH的變化規(guī)律。
解析:水的電離與溫度有關,溫度越高,電離度越大,但[H+]=[OH-]水仍呈中性,A錯;我們知道pH每升高一個單位,對于強酸需要稀釋10倍,而對于弱酸稀釋的倍數超過了10倍,B中由于醋酸為弱酸,稀釋至原來的10倍后,pH<4,B錯;在D中,當酸與堿的pH之和等于14時,等體積混合后,誰弱顯誰性,即pH<7,D錯。
3.(07年廣東化學·15)下列各溶液中,微粒的物質的量濃度關系正確的是
A.0.1mol·L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸鈉溶液中加入適量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸鈉溶液中滴加稀鹽酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
答案:AD
解析:溶液中離子濃度大小比較要綜合運用電離平衡,鹽類水解知識,要記住三個守恒:電荷守恒、物料守恒、質子守恒。A根據質子守恒,水電離出的H+和OH-的物質的量相等,Na2CO3溶液中H+分別以HCO3-、H+、H2CO3形式存在,故A對,B中由于NH4+水解,c(NH4+與c(Cl-)不等,B錯,C中根據電荷守恒有:c(Na+)+ c(H+)==c(OH-)+ c(CH3COO-),因為c(H+)>c(OH-),故c(CH3COO-)>c(Na+),C錯。D中Na+、NO3-不水解加入稀鹽酸后二者的物質的量濃度比仍是1:1,故D對。
2.(07年山東理綜·14)氯氣溶于水達到平衡后,若其他條件不變,只改變某一條件,下列敘述正確的是
A.在通入少量氯氣,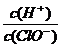 減小
減小
B.通入少量SO2,溶液的漂白性增強
C.加入少量固體NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的電離平衡向正反應方向移動
答案:D
解析:在氯水中存在如下平衡:Cl2+H2O HCl+HClO、H2O
HCl+HClO、H2O H++OH-、HClO
H++OH-、HClO H++ClO-。A中在通入少量氯氣,平衡右移,生成的次氯酸和鹽酸增多,氫離子濃度增大有兩個方面原因,次氯酸濃度增大和鹽酸完全電離,而次氯酸根的增大只受次氯酸濃度增大的影響,故該值增大,錯誤;B中通入二氧化硫,其與氯氣反應生成無漂白性的鹽酸和硫酸,漂白性減弱,錯誤;C中加入少量固體氫氧化鈉反應后的溶液仍是電中性的,但酸堿性不為中性,應為弱酸性。溶液中陰陽離子所帶正負電荷總數相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),但是c(H+)應該大于c(OH-),故此等式不成立,錯誤;D中加水,即稀釋氯水溶液的酸性減弱,即c(H+)減小,所以水的電離平衡向正向移動,正確。
H++ClO-。A中在通入少量氯氣,平衡右移,生成的次氯酸和鹽酸增多,氫離子濃度增大有兩個方面原因,次氯酸濃度增大和鹽酸完全電離,而次氯酸根的增大只受次氯酸濃度增大的影響,故該值增大,錯誤;B中通入二氧化硫,其與氯氣反應生成無漂白性的鹽酸和硫酸,漂白性減弱,錯誤;C中加入少量固體氫氧化鈉反應后的溶液仍是電中性的,但酸堿性不為中性,應為弱酸性。溶液中陰陽離子所帶正負電荷總數相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),但是c(H+)應該大于c(OH-),故此等式不成立,錯誤;D中加水,即稀釋氯水溶液的酸性減弱,即c(H+)減小,所以水的電離平衡向正向移動,正確。
1.(07年山東理綜·10)物質的量濃度相同時,下列既能跟NaOH溶液反應,又能跟鹽酸反應的溶液中,pH最大的是
A.Na2CO3溶液 B.NH4HCO3溶液 C.NaHCO3溶液 D.NaHSO4溶液
答案:C
解析:A中碳酸鈉能和鹽酸反應,不與氫氧化鈉反應,排除;B中碳酸氫銨二者都能反應;C中碳酸氫鈉二者均能反應;D中硫酸氫鈉能和氫氧化鈉反應,不與鹽酸反應,排除。故此題中實際是比較碳酸氫銨和碳酸氫鈉溶液同濃度時pH值大小的比較,碳酸氫銨是弱堿弱酸鹽,而碳酸氫鈉是強堿弱酸鹽,對比可知答案選C。
28.向含有a mol和b mol的混合溶液中,慢慢地加入足量的稀硫酸,使其充分反應后,得到沉淀x mol和標準狀況下的氣體y L。
計算推測當的取值范圍內不同時,x、y的值(用含a、b的式子表示),并推測所得氣體的成分。(空格根據需要可填滿或不填滿)
|
的范圍 |
|
|
氣體成分 |
|
|
|
|
|
|
|
|
/ |
無 |
|
|
|
|
|
|
|
|
|
|
2008學年第二學期七校聯合體高一質量檢測化學試卷
27.將裝有30mL NO和NO2混合氣體的試管倒立于水中, 經過足夠時間, 到水面不再上升為止, 此時試管內剩余氣體的體積為16mL. 求原混合氣體中NO和NO2的體積各是多少毫升?
26.硫代硫酸鈉(Na2S2O3)可看成是一個S原子取代了Na2SO4中的一個O原子而形成。某校化學研究性學習小組運用類比學習的思想,通過實驗探究Na2S2O3的化學性質。
[提出問題]Na2S2O3是否與Na2SO4相似具備下列性質呢?
猜想①: ;
猜想②:溶液呈中性,且不與酸反應;
猜想③:無還原性,不能被氧化劑氧化。
[實驗探究]基于上述猜想②、③,設計實驗方案。
|
|
實驗操作 |
實驗現象或 預期實驗現象 |
現象解釋 |
|
猜想② |
(1) |
溶液pH=8 |
- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
(2) |
S2O32-+2H+=S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水顏色變淺 |
- |
[實驗結論]Na2S2O3能與酸反應,具有還原性,與Na2SO4的化學性質不相似。
[問題討論]
⑴甲同學向探究“猜想③”反應后的溶液中滴加硝酸銀溶液,觀察到有白色沉淀產生,并據此認為氯水可將Na2S2O3氧化。你認為該方案是否正確并說明理由 。
⑵請重新設計一個實驗方案,證明Na2S2O3被氯水氧化。該實驗方案是 。
25.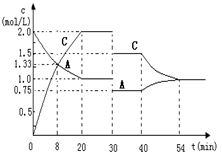
 某密閉容器中充入等物質的量的氣體A和B,一定溫度下發(fā)生反應:A(g)+xB(g)
某密閉容器中充入等物質的量的氣體A和B,一定溫度下發(fā)生反應:A(g)+xB(g) 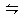 2C(g)達到平衡后,只改變反應的一個條件,測得容器中物質的濃度、反應速率隨時間變化的關系如下圖所示。
2C(g)達到平衡后,只改變反應的一個條件,測得容器中物質的濃度、反應速率隨時間變化的關系如下圖所示。
請回答下列問題:
(1)0-20min,A的平均反應速率為 ;8min時,v(正) v(逆)(填:>、=或<)
(2)反應方程式中的x= ,30min時改變的反應條件是 。
(3)該反應的正反應為 (填:“放熱”或“吸熱”)反應。
24.硫酸具有以下(A)-(E)所示的性質,試選擇正確答案編號填在①-③所示變化的相應空格處:
(A)在水中電離,并呈強酸性;(B)高沸點難揮發(fā);(C)濃硫酸具有吸水性;(D)濃硫酸具有脫水性;(E)濃硫酸具有強氧化性;(F)濃硫酸溶于水入出大量熱。
①銅片與濃硫酸共熱產生二氧化硫氣體______________________。
②將稀硫酸滴在一張紙片上,再烘干(紙片不接觸燈焰),發(fā)現紙片中滴過酸液的部位先變黑最后留下一個洞_________________________。
③蔗糖晶體中滴入適量的濃硫酸,再在滴有濃硫酸處加滴2-3滴水。發(fā)現加水處立即黑,黑色區(qū)不斷擴大,最后變成一塊疏松的焦炭,并伴有刺激性氣味氣體產生。_________。
0.5 mol·L-1硫酸溶液的燒杯中,該鋁片與硫酸
反應產生氫氣的速率與反應時間可用如右的坐標曲
線來表示,回答下列問題:
(1)曲線由0→a段不產生氫氣的原因_______
___________________________,有關的化學方程式為
___________________;
(2)曲線由a→b段產生氫氣的速率較慢的原因_____________________________________;
(3)曲線由b→c段,產生氫氣的速率增加較快的主要原因_________________________;
(4)曲線由c以后,產生氫氣的速率逐漸下降的主要原因_________________________
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com