
13. (09年福建理綜·10)在一定條件下,Na2CO3溶液存在水解平衡:CO32-+H2O
(09年福建理綜·10)在一定條件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列說法正確的是
HCO3-+OH-。下列說法正確的是
 A.稀釋溶液,水解平衡常數增大 B.通入CO2,平衡朝正反應方向移動
A.稀釋溶液,水解平衡常數增大 B.通入CO2,平衡朝正反應方向移動
 C.升高溫度,
C.升高溫度,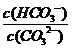 減小 D.加入NaOH固體,溶液pH減小
減小 D.加入NaOH固體,溶液pH減小
答案:B
解析:平衡常數僅與溫度有關,故稀釋時是不變的,A項錯;CO2通入水中,相當于生成H2CO3,可以與OH-反應,而促進平衡正向移動,B項正確;升溫,促進水解,平衡正向移動,故表達式的結果是增大的,C項錯;D項,加入NaOH,堿性肯定增強,pH增大,故錯。
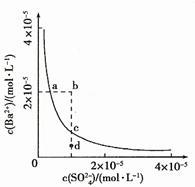
11.(08年山東理綜·15)某溫度時,BaSO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是C
提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常數Ksp=c(Ba2+)·c(SO42-),稱為溶度積常數。
Ba2+(aq)+SO42-(aq)的平衡常數Ksp=c(Ba2+)·c(SO42-),稱為溶度積常數。
A.加入Na2SO4可以使溶液由a點變到b點
B.通過蒸發可以使溶液由d點變到c點
C.d點無BaSO4沉淀生成
D.a點對應的Ksp大于c點對應的Ksp
答案:C
解析:A項,當加入Na2SO4溶液時,c(SO42-)增大,因Ksp為常數,則c(Ba2+)就會減小,故A錯;B項,蒸發可以會使溶液的c(SO42-)和c(Ba2+)都變大,故B錯;C項,在d點時,因其在沉淀溶解平衡點c點的下方,c(Ba2+)較小,故它們濃度的乘積小于Ksp,則無無BaSO4沉淀生成,C正確;D項,因ac兩點對應的都是在相同的溫度下的Ksp,故二者的Ksp相同,D錯。
 12
12 .(09年安徽理綜·13)向體積為0.05mol·L-1CH3COOH溶液中加入體積為Vb的0.05mol·L-1KOH溶液,下列關系錯誤的是
.(09年安徽理綜·13)向體積為0.05mol·L-1CH3COOH溶液中加入體積為Vb的0.05mol·L-1KOH溶液,下列關系錯誤的是
 A.Va>Vb時:c (CH3COOH) +c (CH3COO-)>c (K+)
A.Va>Vb時:c (CH3COOH) +c (CH3COO-)>c (K+)
 B.Va=Vb時:c (CH3COOH) +c (H+)>c
(OH-)
B.Va=Vb時:c (CH3COOH) +c (H+)>c
(OH-)
 C.Va<Vb時:c (CH3COO-)>c (K+)> c (OH-)> c (H)
C.Va<Vb時:c (CH3COO-)>c (K+)> c (OH-)> c (H)
 D.Va與Vb任意比時:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
D.Va與Vb任意比時:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
 答案:C
答案:C
 解析:若Va>Vb,醋酸過量,根據物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,則A選項正確;若Va=Vb,反應后為CH3COOK溶液,由于的CH3COO-水解而顯堿性,根據質子守恒可知,B選項正確;若Va<Vb,說明堿過量,當堿液加的量足夠多,則可以存在c(K+)>c(CH3COO-),C選項錯誤;D選項符合電荷守恒,正確。
解析:若Va>Vb,醋酸過量,根據物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,則A選項正確;若Va=Vb,反應后為CH3COOK溶液,由于的CH3COO-水解而顯堿性,根據質子守恒可知,B選項正確;若Va<Vb,說明堿過量,當堿液加的量足夠多,則可以存在c(K+)>c(CH3COO-),C選項錯誤;D選項符合電荷守恒,正確。
10.(08年江蘇化學·12)下列溶液中有關物質的量濃度關系正確的是AC
A.pH=2的HA溶液與pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三種溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物質的量濃度相等CH3COOH和CH3COONa溶液等體積混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
答案:A、C
 解析:選項A中根據電荷守恒,此關系式正確;選項B中pH相等,溶液中的c(OH-)相等,根據酸性越弱,水解越強,所以溶液中c(Na2CO3)<c(CH3COONa);選項C中根據電荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它們等體積混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,將①×2-②得:c(CH3COO-)
+2c(OH-)
== 2c(H+)
+ c(CH3COOH);選項D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同時也可以判斷HA-以電離為主,所以離子濃度的大小順序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
解析:選項A中根據電荷守恒,此關系式正確;選項B中pH相等,溶液中的c(OH-)相等,根據酸性越弱,水解越強,所以溶液中c(Na2CO3)<c(CH3COONa);選項C中根據電荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它們等體積混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,將①×2-②得:c(CH3COO-)
+2c(OH-)
== 2c(H+)
+ c(CH3COOH);選項D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同時也可以判斷HA-以電離為主,所以離子濃度的大小順序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
9.(08年海南化學·9)下列離子方程式中,屬于水解反應的是C
A.HCOOH+H2O HCOO-
+ H3O+
HCOO-
+ H3O+
B.CO2+H2O HCO3-
+ H+
HCO3-
+ H+
C.CO32-
+ H2O HCO3- + OH-
HCO3- + OH-
D.HS- +
H2O S2-
+ H3O+
S2-
+ H3O+
答案:C
解析:選項A、B、D表示的都是電離。
3.HCl與HAc均反應完后,繼續滴加NH3·H2O弱電解質,電導率變化不大,因為溶液被稀釋,有下降趨勢。
綜上所述:答案選D。
2.當HCl被中和完后,繼續與HAc弱電解質反應,生成NH4Ac的強電解質,所以電導率增大。
8.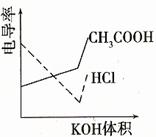 (08年廣東化學·18)電導率是衡量電解質溶液導電能力大小的物理量,根據溶液電導率變化可以確定滴定反應的終應。右圖是KOH溶液分別滴定HCl溶液和CH3COOH溶液的滴定曲線示意圖。下列示意圖中,能正確表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲線的是D
(08年廣東化學·18)電導率是衡量電解質溶液導電能力大小的物理量,根據溶液電導率變化可以確定滴定反應的終應。右圖是KOH溶液分別滴定HCl溶液和CH3COOH溶液的滴定曲線示意圖。下列示意圖中,能正確表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲線的是D
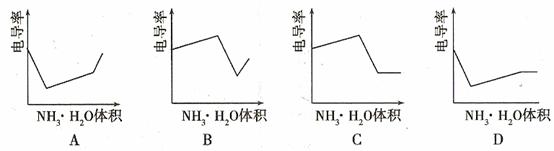
答案:D
解析:1.HCl為強電解質,HAc為弱電解質,滴加NH3·H2O弱電解質先與HCl反應,生成同樣為強電解質的NH4Cl,但溶液體積不斷增大,溶液稀釋,所以電導率下降。
7.(08年廣東化學·17)鹽酸、醋酸和碳酸氫鈉是生活中常見的物質。下列表述正確的是C
A.在NaHCO3溶液中加入與其等物質的量的NaOH,溶液中的陰離子只有CO32-和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL0.10 mol·L-1CH3COOH溶液加入等物質的量的NaOH后,溶液中離子的濃度由大到小的順序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和體積與pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物質的量相同
答案:C
解析:A中,生成Na2CO3溶液,CO32-會發生水解,生成HCO3-,所以A錯;
電荷守恒 :C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-)
物料守恒:C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3)
兩式相減得 :C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 所以B錯誤。
C中,生成NaAc,Ac-水解呈堿性,故C正確;相同PH,相同體積的HCl和HAc,因為HAc為弱酸,所以HAc的物質的量濃度大,HAc所消耗的NaOH的物質的量多,D錯。
6.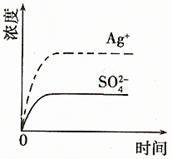 (08年廣東化學·9)已知Ag2SO4的KW 為2.0×10-3,將適量Ag2SO4固體溶于100 mL水中至剛好飽和,該過程中Ag+和SO32-濃度隨時間變化關系如右圖(飽和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1時刻在上述體系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意圖中,能正確表示t1時刻后Ag+和SO32-濃度隨時間變化關系的是B
(08年廣東化學·9)已知Ag2SO4的KW 為2.0×10-3,將適量Ag2SO4固體溶于100 mL水中至剛好飽和,該過程中Ag+和SO32-濃度隨時間變化關系如右圖(飽和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1時刻在上述體系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意圖中,能正確表示t1時刻后Ag+和SO32-濃度隨時間變化關系的是B
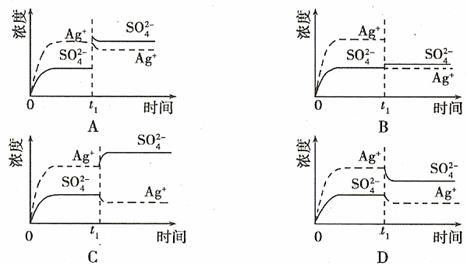
答案:B
解析:Ag2SO4剛好為100ml的飽和溶液,因為c(Ag+)=0.034mol·L-1,所以c(SO42-)=0.017mol·L-1;當加入100ml 0.020mol·L-1Na2SO4溶液后,c(SO42-)=0.0185mol·L-1,c(Ag+)=0.017mol·L-1(此時Q<Ksp)。由計算可知選B。
5.(2007海南·08)下列溶液能與鎂反應生成氫氣的是( )
A.氯化銨溶液 B.氫氧化鈉溶液 C.碳酸鉀溶液 D.飽和石灰水
答案:A
考點:本題考查了鹽的水解規律。
解析:氯化銨是強酸弱堿鹽,水解,顯酸性。相當于發生Mg+2H+=Mg2++H2↑ ,而其他溶液均顯堿性。所以選A。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com