
13. 化學反應中一定伴隨著能量的變化,下列有關能量的說法正確的是
A.等物質的量的硫蒸氣和硫粉分別完全燃燒,后者放出熱量多
B.由C(石墨)→ C(金剛石)-1.9KJ可知,金剛石比石墨穩定
C.根據熱化學方程式:S(s) + O2(g)→ SO2(g) + 297.23 kJ,可推知1 mol SO2 (g)的能量總和大于1 mo S(s)和1 mol O2(g)的能量總和
D.在稀水溶液中 H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,將含0.5 mol H2SO4的濃硫酸與含l mol NaOH的溶液混合時,放出的熱量大于57.3 kJ
12.右圖是銅鋅原電池,某同學做完實驗后記錄如下:
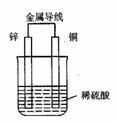 ①Zn為正極,Cu為負極 ②電解質溶液pH不變 ③電子流動的方向為:Zn→Cu ④Cu極上有氫氣產生 ⑤若有1mol電子流過導線,則產生氫氣0.5 mol ⑥該原電池產生氫氣的速度比沒有導線相連時慢
①Zn為正極,Cu為負極 ②電解質溶液pH不變 ③電子流動的方向為:Zn→Cu ④Cu極上有氫氣產生 ⑤若有1mol電子流過導線,則產生氫氣0.5 mol ⑥該原電池產生氫氣的速度比沒有導線相連時慢
上述記錄中描述正確的是
A.①②③ B.①②⑥ C.③④⑤ D.④⑤⑥
11.將一定量的鐵粉和硫粉的混合物共熱,充分反應后冷卻,再加入足量的稀硫酸,得到標準狀況下的氣體11.2 L,則原混合物可能的組成是(n代表物質的量)
A.n(Fe)< n(S) 總質量等于44g B.n(Fe)> n(S) 總質量等于44g C.n(Fe) = n(S) 總質量大于44g D.n(Fe)> n(S) 總質量小于44g
10.已知反應:① 2H2S + O2 → 2S + 2H2O ② 2H2S + SO2 → 3S + 2H2O
③ 2H2S + 3O2 → 2SO2 + 2H2O
將點燃的H2S氣體的導管伸入盛有一定量O2的集氣瓶內,上述3個反應發生的先后順序是
A.①②③ B.③①② C.①③② D. ③②①
9.下列能用勒沙特列原理解釋的是
A.合成氨中采用高溫有利于生產。 B.棕紅色NO2加壓后顏色先變深后變淺;
C.SO2催化氧化成SO3的反應,往往需要使用催化劑;
D.H2、I2、HI平衡混和氣加壓后顏色變深。
8.下列反應的離子方程式中,正確的是
A.氫硫酸中滴入足量NaOH溶液:H2S + 2OH- →S2- + 2H2O
B.NaBr溶液中通入過量Cl2: Br-+ Cl2 → Br2 + Cl-
C.氯化銨溶液中加入氫氧化鈉溶液:NH4Cl +
OH-→ NH3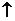 +
Cl- + H2O
+
Cl- + H2O
D.碳酸鋇投入足量的稀鹽酸中:CO32- + 2H+ →CO2↑+ H2O
7. 對可逆反應:N2+3H2 2NH3達平衡時,若分別增大壓強和降低壓強,兩種情況下,對平衡體系正逆反應速率影響較大的依次是
對可逆反應:N2+3H2 2NH3達平衡時,若分別增大壓強和降低壓強,兩種情況下,對平衡體系正逆反應速率影響較大的依次是
A.正反應速率,正反應速率 B.逆反應速率,逆反應速率
C.正反應速率,逆反應速率 D.逆反應速率,正反應速率
6.黑火藥爆炸時的主要反應是:S+2KNO3 +3C →K2S +3CO2↑+N2↑,下列說法正確的是
A.上述反應的生成物都是無毒的,所以燃放爆竹時不會污染環境
B.該反應的發生需要點燃或撞擊,所以它是一個吸熱反應
C.硫磺在黑火藥爆炸的反應中既是氧化劑,又是還原劑
D.KNO3有強氧化性,乘坐汽車、火車、飛機時不能隨身攜帶
5.化合物A、B、C都只含有兩種元素,且A、B均含X元素。已知一定條件下可發生反應:A+B--X+C,X是一種單質,由此可知X元素
A.一定是金屬元素 B.一定是非金屬元素 C.可能是金屬元素,也可能是非金屬元素 D.無法確定
4.下列關于環境問題的說法正確的是
A.燃煤時加適量的生石灰可減少二氧化硫的排放
B.pH在5.6~7.0之間的降水通常稱為酸雨
C.焚燒一次性飯盒可減少白色污染
D.回收廢舊電池的首要原因是回收某些金屬和石墨.
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com