
題目列表(包括答案和解析)
(17分)具有還原性的無水草酸是無色無臭的透明結晶或白色粉末。草酸在濃硫酸并加熱條件下容易脫去水分,分解為二氧化碳和一氧化碳。
(1) 草酸(H2C2O4)分解的化學方程式 為: ,
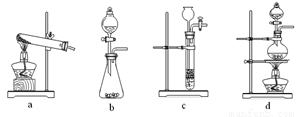
下列裝置中,可用于草酸分解制取氣體的是 。(填字母)
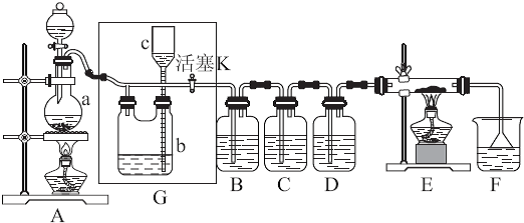
(2) 某探究小組利用草酸分解產生的混合氣體和鐵銹反應來測定鐵銹樣品組成(假定鐵銹中只有Fe2O3·nH2O和Fe兩種成份),實驗裝置如下圖所示,請回答:
① 為得到干燥、純凈的CO氣體,洗氣瓶A、B中盛放的試劑分別是 、 。
② 在點燃酒精燈之前應進行的操作是:(a) ;(b)通入混合氣體一段時間。
③ 準確稱量樣品的質量10.00 g置于硬質玻璃管中,充分反應后冷卻、稱量,硬質玻璃 管中剩余固體質量為8.32 g,D中濃硫酸增重0.72 g,則n= (假定Fe和H2O 不發生反應,實驗過程中每步均完全吸收或反應)。
④ 在本實驗中,下列情況會使測定結果n偏大的是 (填字母)。
a.缺少洗氣瓶B b.缺少裝置E
c.反應后固體是鐵和少量Fe2O3 d.反應后固體是鐵和少量Fe2O3·nH2O
(3) 該探究小組還利用KMnO4酸性溶液與H2C2O4溶液反應過程中溶液紫色消失的方法,研究影響反應速率的因素。
① 請完成以下實驗設計表(表中不要留空格):
(每次實驗KMnO4酸性溶液的用量均為4mL、H2C2O4溶液的用量均為2mL,催化劑 的用量可選擇0.5g、0g)
| 實驗 編號 | 實驗目的 | T/K | 催化劑用量/g | C/mol·l-1:] | |
| KMnO4 | H2C2O4 | ||||
| ① | 為以下實驗作參考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的濃度對該反應速率的影響 | 298 | 0.5 | 0.001 | 0.1 |
| ③ |
| 323 | 0.5 | 0.01 | 0.1 |
| ④ | 探究催化劑對反應速率的影響 |
|
|
| 0.1 |
② 若要準確計算反應速率,該實驗中還需測定溶液紫色消失所需要的時間。請你設計出
通過測定褪色時間長短來判斷濃度大小與反應速率關系的實驗方案 。
(17分)具有還原性的無水草酸是無色無臭的透明結晶或白色粉末。草酸在濃硫酸并加熱條件下容易脫去水分,分解為二氧化碳和一氧化碳。
(1) 草酸(H2C2O4)分解的化學方程式 為: ,
下列裝置中,可用于草酸分解制取氣體的是 。(填字母)
(2) 某探究小組利用草酸分解產生的混合氣體和鐵銹反應來測定鐵銹樣品組成(假定鐵銹中只有Fe2O3·nH2O和Fe兩種成份),實驗裝置如下圖所示,請回答:
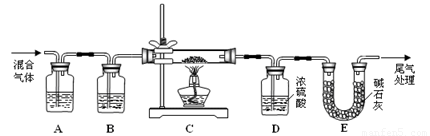
① 為得到干燥、純凈的CO氣體,洗氣瓶A、B中盛放的試劑分別是 、 。
② 在點燃酒精燈之前應進行的操作是:(a) ;(b)通入混合氣體一段時間。
③ 準確稱量樣品的質量10.00 g置于硬質玻璃管中,充分反應后冷卻、稱量,硬質玻璃 管中剩余固體質量為8.32 g,D中濃硫酸增重0.72 g,則n = (假定Fe和H2O 不發生反應,實驗過程中每步均完全吸收或反應)。
④ 在本實驗中,下列情況會使測定結果n偏大的是 (填字母)。
a.缺少洗氣瓶B b.缺少裝置E
c.反應后固體是鐵和少量Fe2O3 d.反應后固體是鐵和少量Fe2O3·nH2O
(3) 該探究小組還利用KMnO4酸性溶液與H2C2O4溶液反應過程中溶液紫色消失的方法,研究影響反應速率的因素。
① 請完成以下實驗設計表(表中不要留空格):
(每次實驗KMnO4酸性溶液的用量均為4mL、H2C2O4溶液的用量均為2mL,催化劑 的用量可選擇0.5g、0g)
|
實驗 編號 |
實驗目的 |
T/K |
催化劑用量/g |
C/mol·l-1:] |
|
|
KMnO4 |
H2C2O4 |
||||
|
① |
為以下實驗作參考 |
298 |
0.5 |
0.01 |
0.1 |
|
② |
探究KMnO4酸性溶液的濃度對該反應速率的影響 |
298 |
0.5 |
0.001 |
0.1 |
|
③ |
|
323 |
0.5 |
0.01 |
0.1 |
|
④ |
探究催化劑對反應速率的影響 |
|
|
|
0.1 |
② 若要準確計算反應速率,該實驗中還需測定溶液紫色消失所需要的時間。請你設計出
通過測定褪色時間長短來判斷濃度大小與反應速率關系的實驗方案 。
(17分)具有還原性的無水草酸是無色無臭的透明結晶或白色粉末。草酸在濃硫酸并加熱條件下容易脫去水分,分解為二氧化碳和一氧化碳。
(1)草酸(H2C2O4)分解的化學方程式 為: ,
下列裝置中,可用于草酸分解制取氣體的是 。(填字母)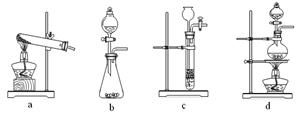
(2)某探究小組利用草酸分解產生的混合氣體和鐵銹反應來測定鐵銹樣品組成(假定鐵銹中只有Fe2O3·nH2O和Fe兩種成份),實驗裝置如下圖所示,請回答: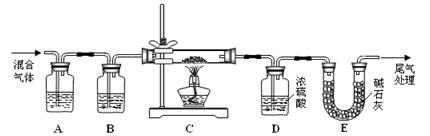
① 為得 到干燥、純凈的CO氣體,洗氣瓶A、B中盛放的試劑分別是 、 。
到干燥、純凈的CO氣體,洗氣瓶A、B中盛放的試劑分別是 、 。
② 在點燃酒精燈之前應進行的操作是:(a) ;(b)通入混合氣體一段時間。
③ 準確稱量樣品的質量10.00 g置于硬質玻璃管中,充分反應后冷卻、稱量,硬質玻璃 管中剩余固體質量為8.32 g,D中濃硫酸增重0.72 g,則n = (假定Fe和H2O 不發生反應,實驗過程中每步均完全吸收或反應)。
④ 在本實驗中,下列情況會使測定結果n偏大的是 (填字母)。
a.缺少洗氣瓶B b.缺少裝置E
c.反應后固體是鐵和少量Fe2O3 d.反應后固體是鐵和少量Fe2O3·nH2O
(3)該探究小組還利用KMnO4酸性溶液與H2C2O4溶液反應過程中溶液紫色消失的方法,研究影響反應速率的因素。
① 請完成以下實驗設計表(表中不要留空格):
(每次實驗KMnO4酸性溶液的用量均為4mL、H2C2O4溶液的用量均為2mL,催化劑 的用量可選擇0.5g、0g)
| 實驗 編號 | 實驗目的 | T/K | 催化劑用量/g | C/mol·l-1:學科網] | |
| KMnO4 | H2C2O4 | ||||
| ① | 為以下實驗作參考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的濃度對該反應速率的影響 | 298 | 0.5 | 0.001 | 0.1 |
| ③ | | 323 | 0.5 | 0.01 | 0.1 |
| ④ | 探究催化劑對反應速率的影響 | | | | 0.1 |
| ||
| ||
| ||
| ||
一學習小組利用下圖所示裝置,對某含少量Fe的廢銅屑進行銅含量的測定,并探究利用其制備硫酸銅溶液。
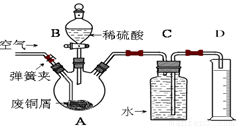
(1)向A中加入10g廢銅屑樣品,關閉彈簧夾,打開B活塞向A注入足量稀硫酸后關閉。①此時裝置C中產生的現象是 。
②反應進行到A中不再產生氣泡時,若C中收集到448mL(已換算成標準狀況)氣體,則該廢銅屑中銅的質量百分含量為 。
(2)接下來使Cu完全溶解的操作是:
① 拆除C、D裝置后,打開彈簧夾
②____________________________________________________________________
(3)為使A中固體加快溶解速率,以下方法運用合理的是 。
a.對A裝置加熱;b.向A內加入少量Fe2O3;c.向A內加入少量CuO;d.增大空氣通入量;e.向A內加入少量FeSO4;f.向A內加入少量H2O
(4)將A中溶液倒入燒杯內,加入Cu2(OH)2CO3將其調節至pH=4時,溶液中鐵元素被完全沉淀,過濾后即得紅褐色沉淀與硫酸銅溶液。
①此過程的離子反應方程式是 。
②檢驗溶液中鐵元素是否被完全沉淀最好的方法是___________
a.取樣于試管→滴加KSCN溶液
b.取樣于試管→滴加酸性KMnO4溶液
c.取樣于試管→紙上層析后→ 噴KSCN溶液;
(5)有同學認為,可以不用測量氣體法計算廢銅屑中銅的質量百分含量,其具體操作步驟可續寫為: 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com