
1.在一定溫度下,弱電解質達到電離平衡時,各種離子濃度之積與溶液中未電離的分子濃度之比是一個常數,該常數就叫電離平衡常數。如CH3COOH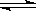 CH3COO-+H+,K=c(CH3COO-)c(H+)/c(CH3COOH).
CH3COO-+H+,K=c(CH3COO-)c(H+)/c(CH3COOH).
4.加入能反應的物質,促進電離,但相關離子濃度降低。
要點二:電離平衡常數
3.同離子效應:加入與弱電解質具有相同的離子的物質,將抑制電離,相關離子濃度增大;
2. 濃度:溶液稀釋促進電離,離子濃度反而變小
1.溫度:升高溫度,促進電離(因為電離過程吸熱),離子濃度增大
4.電解質的強弱與溶液的導電性沒有直接的關系。如難溶物BaCO3,它溶于水的部分能完全電離,故屬于強電解質,但溶液的導電性幾乎為零。
要點一:影響電離平衡的因素:
3.電解質溶液導電性取決于溶液中自由移動離子濃度和離子所帶電荷數的多少。一般來說,相同濃度的強電解質的導電性明顯強于弱電解質。弱酸(堿)與弱堿(酸)反應生成了強電解質,溶液的導電性明顯增強。
2.電解質強弱的判斷,關鍵是看電解質在水溶液中是否完全電離。電解質電離程度與溶解度無直接關系,溶解度大的不一定是強電解質(如醋酸),溶解度小的不一定是弱電解質(如硫酸鋇)。
1.SO2、NH3、CO2的水溶液雖然能導電,但它們仍屬于非電解質
(2)測0.01mol/LHAc溶液的pH>2
(3)測NaAc溶液的pH值: 常溫下,PH>7
(4)測pH= a的HAc稀釋100倍后所得溶液pH<a +2
(5)將物質的量濃度相同的HAc溶液和NaOH溶液等體積混合后溶液呈堿性
(6)中和10mLpH=1的HAc溶液消耗pH=13的NaOH溶液的體積大于10mL
(7)將pH=1的HAc溶液與pH=13的NaOH溶液等體積混合后溶液呈酸性
(8)比較物質的量濃度相同的HAc溶液與鹽酸,分別與同樣的鋅粒反應產生氣體的速率,后者快。
特別提醒:
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com