
答案:⑴124.2;⑵C3H8+5O2=3CO2+4H2O;負;⑶4.2×10-7 mol?L-1;⑷> HCO3-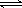 CO32-+H+
CO32-+H+
⑷常溫下,0.1 mol?L-1NaHCO3溶液的pH大于8,則溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用離子方程式和必要的文字說明)。
⑶碳氫化合物完全燃燒生成CO2和H2O。常溫常壓下,空氣中的CO2溶于水,達到平衡時,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的電離及H2CO3的第二級電離,則H2CO3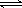 HCO3-+H+的平衡常數K1=
。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常數K1=
。(已知:10-5.60=2.5×10-6)
CH3CH=CH2(g)====CH4(g)+HC≡CH(g) △H2=32.4kJ?mol-1
則相同條件下,反應C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ?mol-1。
⑵以丙烷為燃料制作新型燃料電池,電池的正極通入O2和CO2,負極通入丙烷,電解質是熔融碳酸鹽。電池反應方程式為 ;放電時,CO32-移向電池的 (填“正”或“負”)極。
已知:C3H8(g)====CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ?mol-1
29.(12分)北京奧運會“祥云”火炬燃料是丙烷(C3H8),亞特蘭大奧運會火炬燃料是丙烯(C3H6)。
⑴丙烷脫氫可得丙烯。
⑴冶煉銅的反應為8CuFeS2+21O2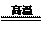 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合價為+2,反應中被還原的元素是 (填元素符號)。
⑵上述冶煉過程產生大量SO2。下列處理方案中合理的是 (填代號)。
a.高空排放
b.用于制備硫酸
c.用純堿溶液吸收制Na2SO4
d.用濃硫酸吸收
⑶過二硫酸鉀(K2S2O8)具有強氧化性,可將I-氧化為I2:S2O82-+2I-=2SO42-+I2
通過改變反應途徑,Fe3+、Fe2+均可催化上述反應。試用離子方程式表示Fe3+對上述反應催化的過程。 、 (不必配平)
⑷利用黃銅礦冶煉銅產生的爐渣(含Fe2O3、FeO、SiO2、Al2O3)可制備Fe2O3。方法為
①用稀鹽酸浸取爐渣,過濾。
②濾液先氧化,再加入過量NaOH溶液,過濾,將沉淀洗滌、干燥、煅燒得Fe2O3。
a.除去Al3+的離子方程式是 。
b.選用提供的試劑,設計實驗驗證爐渣中含有FeO。
提供的試劑:稀鹽酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所選試劑為 。
證明爐渣中含有FeO的實驗現象為 。
答案:⑴Cu、O;⑵b、c;⑶2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;(離子方程式不配平不扣分)⑷a:2Al3++4OH-=AlO2-+2H2O[或Al3++4OH-=Al(OH)4-];b:稀硫酸、KMnO4溶液;稀硫酸浸取爐渣所得溶液使KMnO4溶液褪色
28.(14分)黃銅礦(CuFeS2)是制取銅及其化合物的主要原料之一,還可以制備硫及鐵的化合物。
提示:BaSO4(s) 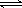 Ba2+(aq)+SO42-(aq)的平衡
Ba2+(aq)+SO42-(aq)的平衡
常數Ksp=c(Ba2+)?c(SO42-),稱為溶度積常數。
A.加入Na2SO4可以使溶液由a點變到b點
B.通過蒸發可以使溶液由d點變到c點
C.d點無BaSO4沉淀生成
D.a點對應的Ksp大于c點對應的Ksp
【必做部分】
15.某溫度時,BaSO4在水中的沉淀溶劑誒平衡曲線如圖所示。下列說法正確的是
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com