
2.熔點高,硬度大,常溫下,化學性質(zhì)不活潑。
1.硅元素在地殼中的含量排第二,在自然界中沒有游離態(tài)的硅,
8.Cu2+水解:與Fe3+結合考查實驗除雜;CuCl2溶液的蒸干、和含有結晶水時除去結晶水,分別對應的操作是加入鹽酸,和在HCl氣氛中加熱。
點評:近幾年的高考題中,有關對銅及其化合物的考查有“升溫”的表現(xiàn)。它的命題有如下特點:一是緊密聯(lián)系生活實際;二是與鐵等其他金屬一同出現(xiàn)在實驗題中。
硅及其化合物
(一)、硅
6.制備CuSO4方案的選擇:方法如下:一是Cu→CuO→CuSO4, 二是用銅和濃硫酸的反應。方案的選擇主要從綠色化學概念角度進行:一是原料利用率高,節(jié)約成本;二是不產(chǎn)生有毒氣體,不造成大氣污染。與之相同的還有Cu(NO3)2的制備。
5.銅與濃硫酸反應:銅與濃硫酸在加熱的條件下發(fā)生反應,不加熱不反應;銅與稀硫酸在加熱條件下也不反應,但在有氧化劑存在的條件下發(fā)生反應,如通入O2(加熱)或加入H2O2,對應的化學方程式為:2Cu+O2+H2SO4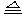 2CuSO4+2H2O,
Cu+2H2O2+H2SO4=CuSO4+4H2O。
2CuSO4+2H2O,
Cu+2H2O2+H2SO4=CuSO4+4H2O。
4.電解硫酸銅溶液:它是考查電解原理及規(guī)律的重要載體,必須熟練書寫其電解方程式。
3.粗銅的精煉:重在考查精煉原理:考查角度為電極材料,電極反應及溶液濃度變化等。精煉原理為:電解池中,粗銅作陽極,精銅作陰極,電解質(zhì)為硫酸銅溶液。陽極反應:Cu- 2e- == Cu2+、Fe-2e-=Fe2+、Ni-2e-= Ni 2+;陰極反應:Cu2++ e- == Cu,硫酸銅溶液濃度降低。
2.波爾多液消毒:主要應用在農(nóng)業(yè)植物殺菌和公共場合的消毒。其主要成分組分CuSO4溶液、石灰水,原理是重金屬鹽能使蛋白質(zhì)變性。重金屬還有Ba、Pb、Hg、Cd、Ag、Au等
1.銅綠的形成:2Cu+O2+CO2+H2O=Cu2(OH)2CO3, 為了避免青銅器生成銅綠,采用的方法是(1)將青銅器保存在干燥的環(huán)境中,(2)不能將青銅器與銀質(zhì)(金屬活性差的金屬)接觸,避免發(fā)生電化學腐蝕。
6.Fe2+、Fe3+、Cu2+、Al3+的除雜:這是近幾年高考實驗命題的熱點。原理是利用Fe3+、Cu2+、Al3+水解完全生成沉淀所需的PH范圍不同。一般操作方法是:先是加入氧化劑(氯氣或H2O2),將Fe2+氧化成Fe3+,然后加入CuO、Cu(OH)2、CuCO3等其他物質(zhì)(以不引入雜質(zhì)離子為準),目的是調(diào)節(jié)溶液的PH,待Fe3+水解完全生成沉淀(此時其他離子不水解),過濾除去。
點評:它和其他金屬及其化合物相比,知識點多,高考命題往往將知識、實驗、化學概念與理論考查集于一身,設計成具有一定綜合性的題目,因此,它在高考中的霸主地位不可動搖。
銅及其化合物
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com