
1.化學反應速率:通常用單位時間內反應物濃度的減小或生成物濃度的增加來表示,其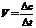 數學表達式可表示為單位一般為mol/(L?min)或mol.?L-1?min-1
數學表達式可表示為單位一般為mol/(L?min)或mol.?L-1?min-1
2.反應熱的數值等于E(形成新鍵釋放的總能量)與E(斷鍵所吸收的總能量)之差,放熱反應△H的符號為“―”,吸熱反應△H的符號為“+”。
特別提醒:
(1)運用蓋斯定律的技巧:參照目標熱化學方程式設計合理的反應途徑,對原熱化學方程式進行恰當“變形”(反寫、乘除某一個數),然后方程式之間進行“加減”,從而得出求算新熱化學方程式反應熱△H的關系式。
(2)具體方法:①熱化學方程式乘以某一個數時,反應熱也必須乘上該數;②熱化學方程式“加減”時,同種物質之間可相“加減”,反應熱也隨之“加減”;③將一個熱化學方程式顛倒時,DH的“+”“―”號也隨之改變,但數值不變。
(4)注意1molH2、O2、、P4分別含有1molH-H、1mol O=O、6molP-P,1molH2O中含有2molO―H,1molNH3含有3molN-H ,1molCH4含有4molC-H。
第二章化學反應速率與化學平衡
1.由蓋斯定律:化學反應不管是一步完成還是分步完成,其反應熱總是相同的。也就是說,化學反應熱只與反應的始態和終態有關,而與具體反應的途徑無關。
(2)能源的開發;①太陽能:每年輻射到地球表面的能量為5×1019kJ,相當于目前全世界能量消耗的1.3萬倍。②生物能:將生物轉化為可燃性的液態或氣態化合物,再利用燃燒放熱。③風能:利用風力進行發電、提水、揚帆助航等技術,風能是一種可再生的干凈能源。④地球能、海洋能。
4.注意表示燃燒熱的熱化學方程式和燃燒的熱化學方程式;表示中和熱的熱化學方程式和表示中和反應的熱化學方程式的不同。燃燒熱以可燃物1mol為標準,且燃燒生成穩定的化合物;中和熱以生成1mol水為標準。
要點二:能源
新能源的開發與利用,日益成為社會關注的焦點,因此,以新型能源開發與利用為背景材料,考查熱化學方程式的書寫及求算反應熱,已成為高考命題的熱點。
關于能源問題,應了解下面的幾個問題:
(1)能源的分類:常規能源(可再生能源,如水等,非再生能源,如煤、石油、天然氣等);新能源(可再生能源,如太陽能、風能、生物能;非再生能源,如核聚變燃料)
3.因燃燒熱、中和熱是確定的放熱反應,具有明確的含義,故在表述時不用帶負號,如CH4的燃燒熱為890KJ/mol。
2.中和熱是指酸、堿的稀溶液發生中和反應生成1 mol水所放出的熱量。注意:弱酸、弱堿電離出H+、OH-需要吸收熱量,故所測定中和熱的數值偏小;濃硫酸與堿測定中和熱時,因濃硫酸釋稀要放熱,故測定的中和熱的數值偏大。
1.燃燒熱指的是1 mol可燃物燃燒生成穩定的化合物時所放出的熱量,注意:穩定的化合物,如H2→H2O(l)而不是H2O(g)、 C→CO2(g)而不是CO 、S→SO2(g)而不是SO3。
生成1mol水時放出的熱量;強酸強堿的中和熱約為57.3 kJ/mol
特別提醒:
可能是1mol,也可能是0.5mol
生成物的量
不限量
H2O是1mol
含義
1mol反應物完全燃燒時放出的熱量;不同反應物,燃燒熱不同
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com