
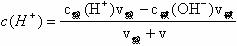
③堿過量時:
2. 強酸和強堿混合
①恰好完全反應:pH=7
②酸過量時:
(2)強堿混合: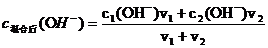
然后,再根據c(H+)= Kw/ c(OH-),求算c(H+)。
3.酸酸混合或堿堿混合溶液pH值計算
(1)強酸混合:
2.溶液的稀釋:
規律:酸:pH= a,加水稀釋10n倍,強酸:pH= a + n,弱酸:pH < a + n
無限稀釋,pH接近7,但不會小于7
堿:pH= b,加水稀釋10n倍,強堿:pH= b-n,弱堿:pH > b-n
無限稀釋,pH接近7,但不會小于7。
1.單一溶液的pH值計算:pH=-lgc(H+)
3.釋稀溶液與PH的關系:
①對于強酸溶液,每稀釋10倍,PH增大一個單位,無論如何沖稀也不會等于或大于7;對于強堿溶液,每沖稀10倍,PH減小一個單位,無論如何沖稀也不會等于或小于7。
②對于PH相同的強酸和弱酸(強堿或弱堿)溶液沖稀相同的倍數,強酸或強堿溶液的PH變化大,這是因為強酸或強堿已完全電離,而弱酸或弱堿還能繼續電離出H+、OH-。
要點二:PH值的計算
2.酸堿性與PH值的關系:
用PH值的大小來判斷溶液的酸堿性,須注意溫度:
常溫下,PH=7的溶液為中性;在
1.溶液酸堿性的判斷依據:
c(H+) >c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)<c(OH-),溶液呈堿性。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com