
4.沉淀溶解平衡是動態平衡,其影響因素主要有:
①溫度:一般升溫時,沉淀溶解度增大,能促進溶解,但要注意Ca(OH)2的溶解度隨溫度的升高而減小。
②同離子效應:增大體系中沉淀溶解平衡中離子濃度,平衡向生成沉淀的方向移動;反之,則向沉淀溶解的方向移動。
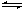
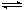 在沉淀后用(s)標明狀態,并用“ ”,如:Ag2S(s)
2Ag+ (aq)+ S2-(aq)
在沉淀后用(s)標明狀態,并用“ ”,如:Ag2S(s)
2Ag+ (aq)+ S2-(aq)
3.溶解平衡方程式的書寫:
2.反應后離子濃度降至1×10-5mol/L以下的反應為完全反應,故用“=”,常見的難溶物在水中的離子濃度均遠低于10-5mol/L
1.溶解度小于
3.掌握三個守恒關系:
(1)電荷守恒:電解質溶液中,不論存在多少種離子,溶液總是呈電中性,即陰離子所帶負電荷總數一定等于陽離子所帶正電荷總數。如在Na2CO3溶液中有c(Na+)+c(H+)=c(HCO3-)+
(2)物料守恒:電解質溶液中,由于某些離子水解或電離,使離子種類增多,但某些主要原子的總數是守恒的。如在Na2 CO3溶液中有c(Na+)=
(3)質子守恒:任何溶液中,最后溶液中僅由水電離出的H+與OH-守恒,即由水電離產生的c(H+)=c(OH-)。在電解質溶液中,由于某些離子發生水解,結合了水電離的H+或OH-,使溶液中c(H+)≠c(OH-),但由水電離出的H+與OH-守恒。如在Na2CO3溶液中有c(OH-)=c(H+)+c(HCO3-)+
八、溶沉淀解平衡及沉淀溶解平衡常數
要點一:沉淀溶解平衡:
2.混合溶液:混合溶液中離子濃度的比較,要注意能發生反應的先反應再比較,同時要注意混合后溶液體積的變化,一般情況下,混合溶液的體積等于各溶液體積之和。在此,常用到以下兩組混合液:①NH
1.多元弱酸、多元弱酸鹽溶液
如H2S溶液: c(H+)>c(HS-)>c(S2一)>c(OH一)。
如Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-) >c(HCO3-)>(H+)。
8.明礬凈水:Al3+水解成氫氧化鋁膠體,膠體具有很大的表面積,吸附水中懸浮物而聚沉
注意:NH4HCO3、(NH4)2CO3溶液兩種離子均可水解且互相促進,但不能水解進行到底,故它們可以大量共存,配成溶液。
七、溶液中離子濃度大小的比較
7.泡沫滅火器中藥劑的使用,如Al2(SO4)3和NaHCO3
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com