
3.根據某些反應的產物推知官能團的位置。如:
(1)由醇氧化得醛或羧酸,-OH一定連接在有2個氫原子的碳原子上;由醇氧化得酮,-OH接在只有一個氫原子的碳原子上。
(2)由消去反應產物可確定“-OH”或“-X”的位置。
(3)由取代產物的種數可確定碳鏈結構。
(4)由加氫后碳的骨架,可確定“C═C”或“C≡C”的位置。
2.根據性質和有關數據推知官能團個數。如-CHO--2Ag--Cu2O;
2-OH--H2;2-COOH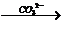 CO2;-COOH
CO2;-COOH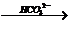 CO2
CO2
1.根據物質的性質推斷官能團,如:能使溴水褐色的物質含有“C═C”或“C≡C”;
能發生銀鏡反應的物質含有“-CHO”;能與鈉發生置換反應的物質含有“-OH”或“-COOH”;能與碳酸鈉溶液作用的物質含有“-COOH”;能水解產生醇和羧酸的物質是酯等。
2.烴的衍生物的重要類別和各類衍生物的重要化學性質
|
類別 |
通式 |
官能團 |
代表物 |
分子結構結點 |
主要化學性質 |
|
鹵代烴 |
R-X |
-X |
C2H5Br |
鹵素原子直接與烴基結合 |
1.與NaOH溶液共熱發生取代反應 2.與NaOH醇溶液共熱發生消去反應 |
|
醇 |
R-OH |
-OH |
C2H5OH |
羥基直接與鏈烴基結合,-O-H及C-O均有極性 |
1.跟活潑金屬反應產生H2 2.跟氫鹵酸反應生成鹵代烴 3.脫水反應 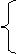 140℃分子間脫水成醚 140℃分子間脫水成醚170℃分子內脫水生成烯 4.催化氧化為醛 5.與羧酸及無機含氧酸反應生成酯 |
|
酚 |
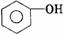 |
-OH |
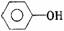 |
-OH直接與苯環上的碳相連 |
1.弱酸性 2.與濃溴水發生取代反應 3.遇FeCl3呈紫色 |
|
醛 |
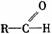 |
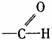 |
 |
 有極性和不飽和性 有極性和不飽和性 |
1.與H2加成為醇 2.被氧化劑氧化為酸(如Ag(NH3)+、Cu(OH)2、O2等) |
|
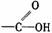
羧酸 |
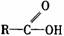 |
 |
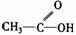 |
受羧基影響,O-H能電離出H+ |
1.具有酸的通性 2.酯化反應 |
|
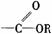
酯 |
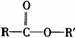 |
 |
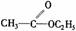 |
分子中RCO-和-OR′之間的C-O鍵易斷裂 |
發生水解反應生成羧酸和醇 |
1.各類烴的代表物的結構、特性
|
|
烷烴 |
烯烴 |
炔烴 |
苯及同系物 |
|
代表物結構式 |
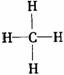 |
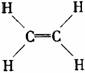 |
H-C≡C-H |
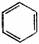 |
|
碳碳鍵長(×10-10m) |
1.54 |
1.33 |
1.20 |
1.40 |
|
鍵
角 |
109°28′ |
約120° |
180° |
120° |
|
分子形狀 |
正四面體 |
平面型 |
直線型 |
平面六邊形 |
|
主要化學性質 |
 光照下的鹵代;裂化;不使酸性KMnO4溶液褪色 光照下的鹵代;裂化;不使酸性KMnO4溶液褪色 |
跟X2、H2、HX、H2O的加成,易被氧化;可加聚 |
跟X2、H2、HX加成;易被氧化 |
跟H2加成;Fe催化下的鹵代;硝化、碘化反應 |
2.寫出有關的化學方程式:
A與B________________________________;C與D_______________________________;E 與無水硫酸銅______________________________;F與Mg______________________________;F與Mg的反應產物與水______________________________。
[解析] “該氣體具有刺激性氣味,并能使潤濕的紅色石蕊試紙變藍”是解答此題的突破口,此氣體只能是NH3,結合題意,F就是N2。因此,從限定的反應物中,只能設法從氨水中獲取.然后結合發生裝置特點(固、液、不加熱)及其他實驗現象,便可推斷其他的物質。
[解答] 1.A.濃氨水;B.氧化鈣;C.氨氣;D.氧化銅;E.水;F.氮氣。2.(略)
[例3] Cu+在酸性溶液中不穩定,可發生自身氧化還原反應生成Cu2+和Cu。 現有濃硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH試紙,而沒有其它試劑。簡述如何用最 簡便的實驗方法來檢驗CuO經氫氣還原所得到的紅色產物中是否含有堿性氧化物Cu2O。
[解析] Cu2O是堿性氧化物,一定可以跟稀硫酸反應,Cu+進入溶液后又可自發 生成Cu2+和Cu,Cu2+在水溶液中呈藍色,而Cu不跟稀硫酸反應。因此可以設想 ,若CuO被H2還原的產物全部是Cu,將其放入稀H2SO4中,無變化;若紅色產物中含有 Cu2O,將其放入稀H2SO4中,溶液會變成藍色。
運用已學過的知識分析其它試劑是否可用,如濃H2SO4、濃HNO3、稀HNO3,因 為它們都有較強的氧化性,不論紅色產物是Cu還是Cu和Cu2O的混合物,將其分別放入這3 種酸中均被氧化為Cu2+,無法檢驗是否存在Cu2O。FeCl3溶液中的Fe3+也 能將Cu氧化為Cu2+,也無法檢驗。而pH試紙則不能用。所以檢驗方法是取少量該紅色 物質放入稀H2SO4中,振蕩,若溶液變為藍色,說明產物中有Cu2O;若溶液不變色, 說明產物中無Cu2O。
1.寫出A-F的物質名稱:
A________________,B________________,C________________ ,D________________,E________________,F________________。
2.訓練發散思維以增強實驗設計能力,提高信息遷移水平
實驗方案的設計往往有許多途徑。為了適應中學生的知識能力水平,中學課本中的某些 實驗可能不是最優的方案。所以在實驗復習中要根據實驗原理來設計實驗步驟和裝置,掌握 一些裝置和儀器藥品的替代方法,力求使設計的實驗儀器簡單、操作便捷、節省試劑、現象明顯、安全防污等,培養和增強實驗設計能力和創造性思維能力。近年來,實驗題中新情境試題不斷增多,這類試題的特點是將基本的實驗操作設計置于新的情境中(主要是中學課本 沒有的新反應或新裝置或是能使中學生理解的最新科技知識、簡化的改進的裝置等),結合學生原有的知識和能力,來進行儀器組裝、現象描述、數據分析、考慮安全和防污等,用來考查考生自學能力、思維能力、分析綜合及評價的能力。由于這類實驗試題情境新穎、設問巧妙、鋪墊得當、知識新、思維量大、所以區分度很好,能確實將一些基礎扎實、自學能力強、思維敏捷、心理素質好的考生選撥出來。所以,新情境實驗試題將是今后實驗試題的命題方向。
試題枚舉
 [例1]
某學生根據高中課本中硝酸鉀受熱分解的實驗操作來判斷硝酸鉛的分解產物 之一是氧氣;將試管中的硝酸鉛加熱到熔融,把帶有火星的細木條伸進試管口,檢驗放出的氣體,當發現木條復燃時該學生即斷言,硝酸鉛受熱分解有氧氣放出。請你對上述實驗及結論的合理性作出評價。如有必要,可提出改進的實驗方案。
[例1]
某學生根據高中課本中硝酸鉀受熱分解的實驗操作來判斷硝酸鉛的分解產物 之一是氧氣;將試管中的硝酸鉛加熱到熔融,把帶有火星的細木條伸進試管口,檢驗放出的氣體,當發現木條復燃時該學生即斷言,硝酸鉛受熱分解有氧氣放出。請你對上述實驗及結論的合理性作出評價。如有必要,可提出改進的實驗方案。
[解析] 有關反應的方程式為:
①2KNO3 2KNO2+O2↑ ②2Pb(NO3)2
2KNO2+O2↑ ②2Pb(NO3)2 2PbO+4NO2+O2↑
2PbO+4NO2+O2↑
比較反應式①和②,其不同之處是②中除生成O2外,還生成了NO2。這一不同又產生了兩個結果。一方面NO2稀釋了O2,O2僅占混合氣體的20%,而這與空氣中O2的 含量相近,因而此處O2不可能使帶火星的木條復燃;另一方面NO2本身也能使帶火星的 木條復燃。因為NO2受熱能放出O2:2NO2 2NO+O2。分析到此, 問題便一清二楚。
2NO+O2。分析到此, 問題便一清二楚。
[答案] 上述實驗及結論在科學上是錯誤的。由于NO2干擾了O2的檢驗,因此應選用NaOH溶液除掉NO2后再檢驗之。
[例2] 研究某一化學反應的實驗裝置如下圖所示:
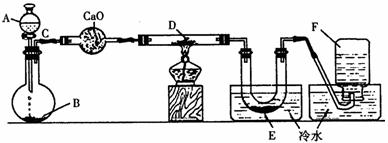
A-F屬于下列物質中的六種物質:濃硫酸、濃鹽酸、濃氨水、稀硫酸、稀鹽酸、稀氮水 、水、鋅粒、銅片、食鹽、高錳酸鉀、氯化鈣、氧化鈣、四氧化三鐵、氧化鐵、氧化銅、氫 氣、二氧化碳、二氧化氮、一氧化碳、氯氣、氯化氫、氨氣、氮氣、氧氣。
實驗現象:
(1)D物質由黑色變為紅色
(2)無水硫酸銅粉末放入無色透明的E中得到藍色溶液
(3)點燃的鎂條伸入無色無味的F中。鎂條表面生成一種灰黃色固體物質。將該發黃色 物質放入水中,有氣體放出,該氣體具有刺激性氣味。并能使潤濕的紅色石蕊試紙變藍。通過分析回答:
1.實驗復習必須集中和分散相結合,提高重要實驗的復現率
“集中”,就是集中復習實驗的基本操作和技能,集中復習一些綜合性的實驗專題,集中歸納總結實驗知識。而“分散”則是指一些性質實驗、制法實驗、驗證或探索性實驗等應分散到元素化合物、有機物、基本理論等的復習過程中去。通過實驗,進一步理解元素化合物等知識,進一步理解相關的實驗原理,提高運用實驗手段解決化學問題的能力,節省復習時間,提高考試成績。
4.各部分知識與技能綜合的實驗設計題
近幾年在高考化學試題的Ⅱ卷,設置一道大的化學實驗題,這些大題的特點是把一些分 散的實驗綜合起來,形成一個整體的實驗題;或者是某些與基本操作、技能或典型實驗有關而又易被忽略的重要細節的試題,主要以教材內容為主進行不同的分解與綜合,以達到新的境地。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com