
3.(13分)某研究性學習小組對過量炭粉與氧化鐵反應的氣體產物成分進行研究。
(1)提出假設:該反應的氣體產物全部都是二氧化碳
(2)設計方案:如下圖所示,將一定量的氧化鐵在隔絕空氣的條件下與過量炭粉完全反應,測量參加反應的碳元素與氧元素的質量比
(2)不正確 (1分)、 將
NH3+H2O NH3?H2O
NH3?H2O NH4++OH-平衡向左移動,有利于NH3揮發放出。
NH4++OH-平衡向左移動,有利于NH3揮發放出。
(4)NH3+CO2+NaC1+H2O=NaHCO3↓+NH
(5)C
II.(1)溫度升高,促進NaHCO3水解
8.8
請你幫助乙同學完成下列內容:
(1)乙同學對產生上述現象原因的預測之一是:加熱時NaHCO3受熱分解生成了Na2CO3。
原因預測之二是 。
(2)查閱資料發現NaHCO3的分解溫度為
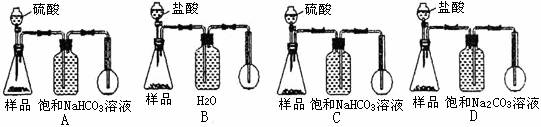
解析:本實驗將定性分析和定量考查進行了有效融合,可很好的考查分析或處理實驗數據,得出合理結論以及知識遷移和再加工的能力。 Ⅰ.由模擬實驗的目的,結合NH3和CO2在飽和NaCl溶液中的溶解度的差異知,應先向飽和NaCl溶液中通入NH3至飽和,然后再通入CO2,這樣可吸收大量的CO2,利于形成NaHCO3。結合裝置可知A裝置產生CO2中常混有HCl,應通入D裝置中洗氣,除去CO2中混有的HCl雜質后在通入C裝置;裝置B產生NH3可直接通入C裝置,但因NH3極易溶解,應防止倒吸,故應接c(靠干燥管的球形部分防倒吸),故裝置的連接順序為:a→f→e→d;b→c。(5)本實驗是通過測量液體的體積求出一定量的Na2CO3樣品產生CO2的體積,進而求出Na2CO3樣品的純度。裝置A、B是長進短出,故無法排出液體;D中Na2CO3可與CO2作用,故應選C裝置。Ⅱ.(1)pH升高的另一原因是促進了HCO3-的水解;(2)因NaHCO3分解需要
答案:I.(1)f e d c (2分,錯一項不得分)
(2)飽和NaHCO3溶液 (1分) 、防止發生倒吸 (1分) 、 漏斗 (1分)
(3)生石灰與水反應,放出大量熱,生成物是強堿,都使
8.5
8.4
8.3
|