
題目列表(包括答案和解析)
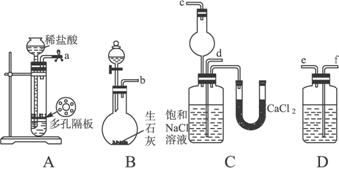
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓一裝置發生反應,直到產生的氣體不能再在C中溶解時,再通入另一裝置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:過濾C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的NaCl粉末,有NH4C1晶體析出……請回答下列問題:
(1)裝置的連接順序是:a接_______;_______接_______;b接_______。
(2)A中常選用的固體反應物為,D中應選用的液體為,B中發生反應的化學方程式為
_______________________________________________。
(3)第二步驟中必須先讓_________________裝置發生反應。
(4)C中用球形干燥管而不用直導管,其作用是________________________,C中廣口瓶內產生固體的總化學方程式為_____________________________________________________。
(5)第四步中分離出NH4Cl晶體的操作是___________;所得的NH4Cl晶體中常含有少量的NaCl和NaHCO3約占5%—8%),請設計一個簡單的實驗證明所得固體的成分大部分是NH4Cl。簡要寫出操作和現象:_________________________________________________。
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓一裝置發生反應,直到產生的氣體不能再在C中溶解時,再通入另一裝置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:過濾C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的NaCl粉末,有NH4Cl晶體析出。……
請完成下列問題:
(1)裝置的連接順序是:(a)接( ) ( )接( );(b)接( )

(2)A中常選用的固體反應物為____________;D中應選用的液體為____________;B中發生反應的化學方程式為_________________________________________________________。
(3)第二步驟中必須先讓_______________裝置先發生反應。
(4)C中用球形干燥管而不用直導管,其作用是____________________________________,C中廣口瓶內產生固體的總化學方程式為______________________________________。
(5)第四步中分離出NH4Cl晶體的操作是___________________;其所得的NH4Cl晶體中常含有少量的NaCl和NaHCO3(約占5%—8%),請設計一個簡單的實驗證明所得固體的成分大部分是NH4Cl。簡要寫出操作和現象:______________________________________。
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓一裝置發生反應,直到產生的氣體不能再在C中溶解時,再通入另一裝置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:過濾C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的NaCl粉末,又有晶體析出,……
請回答下列問題:

(1)裝置的連接順序是:(a)接(_________)![]() (_________)接(_________);
(_________)接(_________);
(b)接(_________)。
(2)A中常選用的固體反應物為_________;D中應選用的液體為_________。
(3)B裝置中分液漏斗內所加試劑為_________;第二步中必須先讓_________裝置發生反應。c中用球形干燥管而不用直導管,其作用是_________。
(4)第四步分離所得的晶體中含有多種成分,試證明其中含有NH4CI,簡要寫出操作過程和現象____________________。

四種鹽在不同溫度下的溶解度(g/
溫度 溶解度 鹽 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(說明:①>
請回答以下問題:
(1)裝置的連接順序應是__________(填字母)。
(2)A裝置中盛放的試劑是__________,其作用是__________。
(3)在實驗過程中,需要控制D溫度在30—
(4)反應結束后,將錐形瓶浸在冷水中析出NaHCO3晶體的原因是____________________
_____________________。用蒸餾水洗滌NaHCO3晶體的目的是除去____________雜質(以化學式表示)。
(5)測試純堿產品中NaHCO3含量的方法是:準確稱取純堿樣品W g,放入錐形瓶中加蒸餾水溶解,加1—2滴酚酞指示劑,用物質的量濃度為c mol·L-1的HCl溶液滴定至溶液由紅色到無色(指示![]() +H+
+H+![]()
![]() 反應的終點),所用HCl溶液體積為V1 mL,再加1—2滴甲基橙指示劑,繼續用HCl溶液滴定溶液由黃變橙,所用HCl溶液體積為V2 mL。寫出純堿樣品中NaHCO3質量分數的計算式:NaHCO3(%)=_______________________________。
反應的終點),所用HCl溶液體積為V1 mL,再加1—2滴甲基橙指示劑,繼續用HCl溶液滴定溶液由黃變橙,所用HCl溶液體積為V2 mL。寫出純堿樣品中NaHCO3質量分數的計算式:NaHCO3(%)=_______________________________。
(1)碳酸氫銨與飽和食鹽水反應,能析出碳酸氫鈉晶體的原因是____________(填標號)。
A.碳酸氫鈉難溶于水
B.碳酸氫鈉受熱易分解
C.碳酸氫鈉的溶解度相對較小,所以在溶液中首先結晶析出
(2)某探究活動小組根據上述制堿原理,進行碳酸氫鈉的制備實驗,同學們按各自設計的方案實驗。
①一位同學將二氧化碳氣體通入含氨的飽和食鹽水中制備碳酸氫鈉,實驗裝置如下圖所示(圖中夾持、固定用的儀器未畫出)。
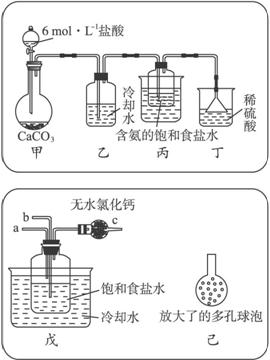
試回答下列有關問題:
(Ⅰ)乙裝置中的試劑是____________。
(Ⅱ)丁裝置中稀硫酸的作用是__________________________________________________
____________________________________________________________________。
(Ⅲ)實驗結束后,分離出NaHCO3晶體的操作是____________(填分離操作的名稱)。
②另一位同學用圖中戊裝置(其他裝置未畫出)進行實驗。
(Ⅰ)實驗時,須先從____________管通入____________氣體,再從____________管中通入____________氣體。
(Ⅱ)有同學建議在戊裝置的b管下端連接己裝置,理由是____________。
(3)請你再寫出一種實驗室制取少量碳酸氫鈉的方法:_______________________________。
1.(16分)
(1)①洗去油污(1分);③在②的濾液中加入稍過量的洗滌過的廢鐵屑,充分反應后過濾(1分);④將③的濾渣溶入足量的稀硫酸中,過濾,濾液保留待用(1分);(2)⑤、③(1分),將溶液加熱到
(3)否(1分),普通自來水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl氣體進入C中,消耗NaOH, 降低NaClO的純度。(2分)(共3分)
|