
3、為什么雙分子膜以頭向外而尾向內的方式排列?
[匯報]1、分子的一端有極性,稱為親水基團。分子的另一端沒有或者幾乎沒有極性,稱為疏水基團。表面活性劑(surfactant)是指具有固定的親水親油基團,在溶液的表面能定向排列,并能使表面張力顯著下降的物質。表面活性劑在水中會形成親水基團向外、疏水基團向內的“膠束”,由于油漬等污垢是疏水的,會被包裹在膠束內腔,這就是肥皂和洗滌劑的去污原理。
2、什么是單分子膜?雙分子膜?舉例說明。

3、鍵長越長,鍵能越小,鍵越易斷裂,化學性質越活潑。
[投影]表2-3:CO分子和N2分子的某些性質

[講]表2-3數據表明,CO分子和N2分子在許多性質上十分相似,這些相似性,可以歸結為它們具有相等的價電子總數,導致它們具有相似的化學結構,由此形成了等電子原理的概念一一原子總數相同、價電子總數相同的分子具有相似的化學鍵特征,它們的許多性質是相近的。
[板書]三、等電子原理
等電子原理:原子總數相同、價電子總數相同的分子具有相似的化學鍵特征,它們的許多性質是相近的。
[講]等電子體的價電子總數相同,而組成原子核外電子總數不一定相同。
[思考]我們學過的等電子物質還有哪些?試舉例。
[投影小結]常見的等電子體
|
類型 |
實例 |
空間構型 |
|
二原子10電子的等電子體 |
N2、CO、NO+、C22-、CN- |
直線型 |
|
三原子16電子的等電子體 |
CO2、CS2、N2O、NCO-、NO2+、N3-、NCS-、BeCl2 |
直線型 |
|
三原子18電子的等電子體 |
NO2-、O3、SO2 |
V型 |
|
四原子24電子的等電子體 |
NO3―、CO32-、BO33-、CS33-、BF3、SO3 |
平面三角形 |
|
五原子32電子的等電子體 |
SiF4、CCl4、BF4-、SO42-、PO43- |
四個σ鍵,正四面體形 |
|
七原子48電子的等電子體 |
SF6、PF6-、SiF62-、AlF63- |
六個σ鍵,正八面體 |
[講]等電子體的應用:判斷一些簡單分子或離子的立體構型 ;利用等電子體在性質上的相似性制造新材料;利用等電子原理針對某物質找等電子體。
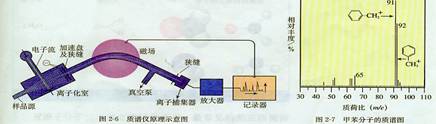
[自學]科學視野:用質譜儀測定分子結構
現代化學常利用質譜儀測定分子的結構。它的基本原理是在質譜儀中使分子失去電子變成帶正電荷的分子離子和碎片離子等粒子。由于生成的分子離子、碎片離子具有不同的相對質量,它們在高壓電場加速后,通過狹縫進入磁場分析器得到分離,在記錄儀上呈現一系列峰,化學家對這些峰進行系統分析,便可得知樣品分子的結構。例如,圖2-7的縱坐標是相對豐度(與粒子的濃度成正比),橫坐標是粒子的質量與電荷之比(m/e),簡稱質荷比。化學家通過分析得知,m/e=92的峰是甲苯分子的正離子(C6H5CH3+),m/e=91的峰是丟失一個氫原子的的C6H5CH2+ ,m/e=65的峰是分子碎片……因此,化學家便可推測被測物是甲苯。

2、鍵能大小是:F-H>O-H>N-H
3.通過上述例子,你認為鍵長、鍵能對分子的化學性質有什么影響?
[匯報]1、形成2 mo1HCl釋放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ
形成2 mo1HBr釋放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ
HCl釋放能量比HBr釋放能量多,因而生成的HCl更穩定,即HBr更容易發生熱分解生成相應的單質.
2.N2、02、F2跟H2的反應能力依次增強,從鍵能的角度應如何理解這一化學事實?
1、關于乙醇分子的說法正確的是 ( )
A.分子中共含有8個極性鍵 B.分子中不含非極性鍵
C.分子中只含σ鍵 D.分子中含有1個π鍵
(解析)乙醇的結構簡式為:CH3CH2OH。共有有8個共價鍵,其中C-H、C-O、O-H鍵為極性鍵,共7個,C-C鍵為非極性鍵,由于全為單鍵,故無π鍵。 (答案) C
(點評) 通過物質的結構式,可以快速有效地判斷鍵的種類及數目,判斷成鍵方式時,需掌握規律:共價單鍵全是σ鍵,共價雙鍵中一個是σ鍵,另一個是π鍵;共價叁鍵中一個σ鍵,另兩個為π鍵。
教 案
長春市第二實驗中學 李佳惠
(lijiahui82@)
|
課題:第二章 第一節 共價鍵(2) |
授課班級 |
|
||||||||||||||||||||||||||||||||
|
課 時 |
|
|||||||||||||||||||||||||||||||||
|
教 學 目 的 |
知識 與 技能 |
1.認識鍵能、鍵長、鍵角等鍵參數的概念 2.能用鍵參數――鍵能、鍵長、鍵角說明簡單分子的某些性質 3.知道等電子原理,結合實例說明“等電子原理的應用 |
||||||||||||||||||||||||||||||||
|
過程 與 方法 |
|
|||||||||||||||||||||||||||||||||
|
情感 態度 價值觀 |
|
|||||||||||||||||||||||||||||||||
|
重 點 |
用鍵能、鍵長、鍵角等說明簡單分子的某些性質 |
|||||||||||||||||||||||||||||||||
|
難 點 |
鍵角 |
|||||||||||||||||||||||||||||||||
|
知 識 結 構 與 板 書 設 計 |
二、鍵參數-鍵能、鍵長與鍵角 1、鍵能:氣態基態原子形成l mol化學鍵釋放的最低能量。通常取正值。 鍵能越大,化學鍵越穩定。 2、鍵長:形成共價鍵的兩個原子之間的核間距。 鍵長越短,鍵能越大,共價鍵越穩定。 3、鍵角:在原子數超過2的分子中,兩個共價鍵間的夾角稱為鍵角。 鍵角決定了分子的空間構型 三、等電子原理 等電子原理:原子總數相同、價電子總數相同的分子具有相似的化學鍵特征,它們的許多性質是相近的。 |
|||||||||||||||||||||||||||||||||
|
教學過程 |
||||||||||||||||||||||||||||||||||
|
教學步驟、內容 |
教學方法、手段、師生活動 |
|||||||||||||||||||||||||||||||||
|
[創設問題情境]N2與H2在常溫下很難反應,必須在高溫下才能發生反應,而F2與H2在冷暗處就能發生化學反應,為什么? [復習]σ鍵、π鍵的形成條件及特點。 [過渡]今節課我們繼續研究共價鍵的三個參數。 [板書]二、鍵參數-鍵能、鍵長與鍵角 [問]電離能概念。 [講]在第一章討論過原子的電離能,我們知道,原子失去電子要吸收能量。反過來,原子吸引電子,要放出能量。因此,原子形成共價鍵相互結合,放出能量,由此形成了鍵能的概念。鍵能是氣態基態原子形成l mol化學鍵釋放的最低能量。例如,形成l mol H-H鍵釋放的最低能量為436.0 kJ,形成1 molN三N鍵釋放的最低能量為946 kJ,這些能量就是相應化學鍵的鍵能,通常取正值。 [板書]1、鍵能:氣態基態原子形成l mol化學鍵釋放的最低能量。通常取正值。 [講]單位kJ/mol,大家要注意的是,應為氣態原子,以確保釋放能量最低。 [投影]表2-1某些共價鍵鍵能  [思考與交流]鍵能大小與化學鍵穩定性的關系? [講]鍵能越大,即形成化學鍵時放出的能量越多,意味著這個化學鍵越穩定,越不容易被打斷。結構相似的分子中,化學鍵鍵能越大,分子越穩定。 [板書] 鍵能越大,化學鍵越穩定。 [講]鍵長是衡量共價鍵穩定性的另一個參數,是形成共價鍵的兩個原子之間的核間距。 [板書]2、鍵長:形成共價鍵的兩個原子之間的核間距。 [投影]表2-2 某些共價鍵的鍵長  [講]1pm=10-12m。因成鍵時原子軌道發生重疊,鍵長小于成鍵原子的原子半徑各。是衡量共價鍵穩定性的另一個叁數。 [投影]資料卡片---共價半徑:相同原子的共價鍵鍵長的一半稱為共價半徑。 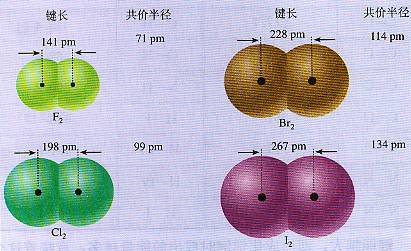 [思考與交流]鍵長與鍵能的關系? [板書]鍵長越短,鍵能越大,共價鍵越穩定。 [過渡]分子的形狀有共價鍵之間的夾角決定,下面我們學習鍵角。 [板書]3、鍵角:在原子數超過2的分子中,兩個共價鍵間的夾角稱為鍵角。 [講]在原子數超過2的分子中,兩個共價鍵之間的夾角稱為鍵角。例如,三原子分子CO-的結構式為O=C=O,它的鍵角為180°,是一種直線形分子;又如,三原子分子H20的H-O-H鍵角為105°,是一種角形(V形)分子。多原子分子的鍵角一定,表明共價鍵具有方向性。鍵角是描述分子立體結構的重要參數,分子的許多性質都與鍵角有關。 [板書] 鍵角決定了分子的空間構型 [講]多原子分子中共價鍵形成的鍵角,表明共價鍵具有方向性。 [投影小結]
[思考與交流]1、試利用表2-l的數據進行計算,1 mo1 H2分別跟l molCl2、lmolBr2(蒸氣)反應,分別形成2 mo1HCl分子和2molHBr分子,哪一個反應釋放的能量更多?如何用計算的結果說明氯化氫分子和溴化氫分子哪個更容易發生熱分解生成相應的單質? 3、乙烷:7個σ鍵 乙烯 :5個σ鍵一個π鍵 乙炔:3個σ鍵兩個π鍵 [小結]電子配對理論:如果兩個原子之間共用兩個電子,一般情況下,這兩個電子必須配對才能形成化學鍵 [投影]
[過]下面,讓我們總結一下,共價鍵都具有哪些特征 [板書]4、共價鍵的特征 [講]按照共價鍵的共用電子對理論,一個原子有幾個未成對電子,便可和幾個自旋方向相反的電子配對成鍵,這就是共價鍵的飽和性。H原子、CL原子都只有一個未成對電子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。 [板書] (1)飽和性 [講]共價鍵的飽和性決定了共價化合物的分子組成 [講]共價鍵形成時,兩個叁數與成鍵的原子軌道總是盡可能沿著電子出現概率最大的方向重疊,而且原子軌道重疊越多,電子在兩核間出現概率越多,形成的共價鍵越牢固。電子所在的原子軌道都是有一定的形狀,所以要取得最大重疊,共價鍵必然有方向性。 [板書](2)方向性 [講]同種分子(如HX)中成鍵原子電子云(原子軌道)重疊程度越大,形成的共價鍵越牢固,分子結構越穩定。如HX的穩定性:HF>HCl>HBr>HI。 [小結]
[隨堂練習] 20.(2008山東理)甲乙兩隊參加奧運知識競賽,每隊3人,每人回答一個問題,答對者為本隊贏得一分,答錯得零分。假設甲隊中每人答對的概率均為 (Ⅱ)用A表示“甲、乙兩個隊總得分之和等于3”這一事件,用B表示“甲隊總得分大于乙隊總得分”這一事件,求P(AB). 19. (2007天津理) 已知甲盒內有大小相同的1個紅球和3個黑球,乙盒內有大小相同的2個紅球和4個黑球.現從甲、乙兩個盒內各任取2個球. (Ⅰ)求取出的4個球均為黑球的概率; (Ⅱ)求取出的4個球中恰有1個紅球的概率; (Ⅲ)設 同步練習冊答案 湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區 違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com版權聲明:本站所有文章,圖片來源于網絡,著作權及版權歸原作者所有,轉載無意侵犯版權,如有侵權,請作者速來函告知,我們將盡快處理,聯系qq:3310059649。 ICP備案序號: 滬ICP備07509807號-10 鄂公網安備42018502000812號 |