
例9.(09年寧夏理綜·27)(15分)下圖表示有關物質(均由短周期元素形成)之間
的轉化關系,其中A為常見的金屬單質,B為非金屬單質(一般是黑色粉末),C是常見的無色無味液體,D是淡黃色的固體化合物。(反應條件圖中已省略。)
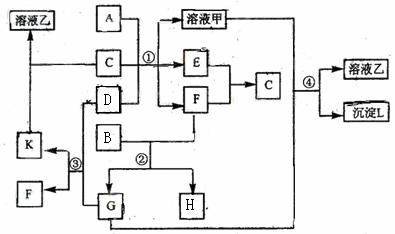
(1)A、B、C、D代表的物質分別為 、 、 、 (填化學式);
(2)反應①中的C、D均過量,該反應的化學方程式是 ;
(3)反應②中,若B與F物質的量之比為4∶3,G、H分別是 、 (填化學式);
(4)反應③產物中K的化學式為 ;
(5)反應④的離子方程式為 。
[解析]D是淡黃色的固體化合物是本題的突破口,根據中學化學知識基本鎖定Na2O2,能與水和CO2反應,但是題目另一信息C是常見的無色無味液體說明C是水,則G為CO2;再依據K能溶于水,說明K為Na2CO3 ,F為O2; 題給信息黑色單質B與氧氣(F)反應得到G(CO2),說明B為C(碳);依據F(O2)與E反應生成C(水)可知E為氫氣,再根據金屬A與堿性溶液反應產生氫氣,可得到A為Al.
[答案](1)Al C Na2O2 (2)2H2O +Na2O2 =4NaOH+O2↑
2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
(3)CO2 CO (4)Na2CO3 (5)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
例10.(08年寧夏理綜·26)
某廠的酸性工業廢水中含有一定量的Fe3+、Cu2+、Au3+等離子。有人設計了圖中的工藝流程,利用常用的酸、堿和工業生產中的廢鐵屑,從廢水中回收金,并生產一定量的鐵紅和氧化銅。
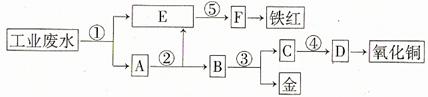
填寫下面空白。
(1)圖中標號處需加入的相應物質分別是① 、② 、③ 、④ 、⑤ ;
(2)寫出①處發生反應的離子方程式 ;寫出③處發生反應的化學方程式 ;
(3)鐵紅的化學式為 ;分別寫出鐵紅和氧化銅在工業上的一種主要用途:鐵紅 ;氧化銅 。
[解析]首先用過量鐵屑將H+、Fe3+、Cu2+、Au3+等離子還原成H2、Fe2+、Cu、Au,發生4個反應,E中應為Fe2+,因為后面生成鐵紅,故⑤為堿液氫氧化鈉,試劑②是將過量鐵屑溶解,試劑③是將Cu、Au分離應為稀硝酸,從C中的Cu2+到氧化銅,也應為堿液氫氧化鈉。
[答案]
(1)①鐵屑 ②稀硫酸 ③稀硝酸 ④氫氧化鈉 ⑤氫氧化鈉
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作紅色涂料 用作制造銅鹽的原料
例8.(09年廣東)出土的錫青銅(銅錫合金)文物常有Cu2(OH)3Cl覆蓋在其表面。下列說法正確的是
 A. 錫青銅的熔點比純銅高
A. 錫青銅的熔點比純銅高
 B.在自然環境中,錫青銅中的錫對銅起保護作用
B.在自然環境中,錫青銅中的錫對銅起保護作用
 C.錫青銅文物在潮濕環境中的腐蝕比干燥環境中快
C.錫青銅文物在潮濕環境中的腐蝕比干燥環境中快
 D.生成Cu2(OH)3Cl覆蓋物是電化學腐蝕過程,但不是化學反應過程
D.生成Cu2(OH)3Cl覆蓋物是電化學腐蝕過程,但不是化學反應過程
 [解析]錫青銅屬于合金根據合金的特性,熔點比任何一種純金屬的低判斷A錯;由于錫比銅活潑,故在發生電化學腐蝕時,錫失電子保護銅,B正確;潮濕的環境將會加快金屬的腐蝕速率,C正確;電化學腐蝕過程實質是有電子的轉移,屬于化學反應過程,D錯。
[解析]錫青銅屬于合金根據合金的特性,熔點比任何一種純金屬的低判斷A錯;由于錫比銅活潑,故在發生電化學腐蝕時,錫失電子保護銅,B正確;潮濕的環境將會加快金屬的腐蝕速率,C正確;電化學腐蝕過程實質是有電子的轉移,屬于化學反應過程,D錯。
 答案:BC
答案:BC

 例6(09年福建)
例6(09年福建) 從鋁土礦(主要成分是
從鋁土礦(主要成分是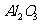 ,含
,含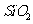 、
、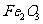 、MgO等雜質)中提取兩種工藝品的流程如下:
、MgO等雜質)中提取兩種工藝品的流程如下:
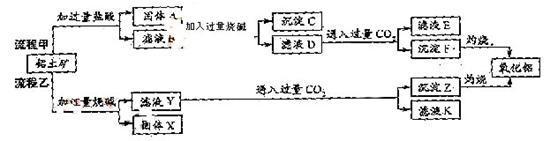

 請回答下列問題:
請回答下列問題:
 (1)流程甲加入鹽酸后生成Al3+的方程式為_________.
(1)流程甲加入鹽酸后生成Al3+的方程式為_________.
 (2)流程乙加入燒堿后生成Si
(2)流程乙加入燒堿后生成Si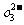 的離子方程式為________.
的離子方程式為________.
 (3)驗證濾液B含
(3)驗證濾液B含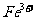 ,可取少量濾液并加入________(填試劑名稱)。
,可取少量濾液并加入________(填試劑名稱)。
 (4)濾液E、K中溶質的主要成份是________(填化學式),寫出該溶液的一種用途________
(4)濾液E、K中溶質的主要成份是________(填化學式),寫出該溶液的一種用途________
 (5)已知298K時,
(5)已知298K時,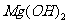 的容度積常數
的容度積常數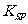 =5.6×
=5.6×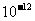 ,取適量的濾液B,加入一定量的燒堿達到沉淀溶液平衡,測得PH=13.00,則此溫度下殘留在溶液中的
,取適量的濾液B,加入一定量的燒堿達到沉淀溶液平衡,測得PH=13.00,則此溫度下殘留在溶液中的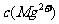 =_______.
=_______.
[解析]本題考查鋁土礦中氧化鋁提取的工藝流程。(1)與HCl反應生成Al3+,應為鋁土礦中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)檢驗Fe3+的特征反應很多,如與KSCN顯血紅色,與苯酚顯紫色,與OH-顯紅褐色沉淀等。(4)生成E、K時,CO2均是過量的,故應生成NaHCO3。(5)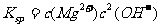 ,
,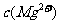 =5.6×10-12/(0.1)2=5.6×10-10。
=5.6×10-12/(0.1)2=5.6×10-10。
[答案](1)Al2O3 + 6H+  2Al3+ +3H2O (2)SiO2 + 2OH-
2Al3+ +3H2O (2)SiO2 + 2OH-  SiO32 - + H2O
SiO32 - + H2O
(3)硫氰化鉀(或硫氰酸鉀、苯酚溶液等合理答案)
(4)NaHCO3;制純堿或做發酵粉等合理答案 (5)5.6×10-10mol/L
例 7.(09年江蘇化學·5)化學在生產和日常生活中有著重要的應用。下列說法不正確的
7.(09年江蘇化學·5)化學在生產和日常生活中有著重要的應用。下列說法不正確的
是 ( )
 A.明礬水解形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化
A.明礬水解形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化
 B.在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速率
B.在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速率
 C.MgO的熔點很高,可用于制作耐高溫材料
C.MgO的熔點很高,可用于制作耐高溫材料
 D.電解MgCl2飽和溶液,可制得金屬鎂
D.電解MgCl2飽和溶液,可制得金屬鎂
 解析:A項,明礬凈水的原理是Al3++3H2O
解析:A項,明礬凈水的原理是Al3++3H2O Al(OH)3(膠體)+3H+,利用Al(OH)3(膠體)的吸附性進行凈水;B項,是因為輪船主要用鐵造外殼,鐵在海水中易被腐蝕.鍍上比鐵活潑的鋅,形成原電池,鋅作負極,失去電子先被腐蝕,從而起到保護鐵的作用,從而可減緩船體的腐蝕速率;氧化鎂的熔點是2852℃,可用于制作耐高溫材料;電解MgCl2飽和溶液,發生地化學反應為MgCl2+2H2O
Al(OH)3(膠體)+3H+,利用Al(OH)3(膠體)的吸附性進行凈水;B項,是因為輪船主要用鐵造外殼,鐵在海水中易被腐蝕.鍍上比鐵活潑的鋅,形成原電池,鋅作負極,失去電子先被腐蝕,從而起到保護鐵的作用,從而可減緩船體的腐蝕速率;氧化鎂的熔點是2852℃,可用于制作耐高溫材料;電解MgCl2飽和溶液,發生地化學反應為MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不會產生金屬鎂,電解熔融的MgCl2能制取單質鎂,發生的反應MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不會產生金屬鎂,電解熔融的MgCl2能制取單質鎂,發生的反應MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
 答案:D
答案:D
例4.(09年海南化學·3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳氣體 B.加入氫氧化鋇溶液
C.加入澄清石灰水 D.加入稀鹽酸
[解析]除雜方法要操作簡便、效果好、不帶來新的雜質、保留非雜質成份。溶液中可用這樣的方法: Na2CO3 + H2O + CO2 = 2NaHCO3。
[答案]A
例5. 某天然堿(純凈物)可看作由CO2和NaOH反應后的產物所組成。稱取天然堿樣品四份,溶于水后,分別逐滴加入相同濃度的鹽酸溶液30mL,產生CO2的體積(標準狀況)如下表:(2000年上海高考題)
|
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
鹽酸液的體積(mL) |
30 |
30 |
30 |
30 |
|
樣品(g) |
3.32 |
4.15 |
5.81 |
7.47 |
|
二氧化碳的體積(mL) |
672 |
840 |
896 |
672 |
(1)由第Ⅰ組數據中的CO2體積與樣品質量之比,可以推測用2.49 g樣品進行同樣的實驗時,產生CO2_________mL(標準狀況)。
(2)另取3.32g天然堿樣品于300℃加熱分解至完全(300℃時Na2CO3不分解),產生CO2112mL(標準狀況)和水0.45g,計算并確定該天然堿的化學式。
(3)已知Na2CO3和HCl(aq)的反應分下列兩步進行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ組數據可以確定所用的HCL(aq)的濃度為 mol/L。
(4)依據上表所列數據以及天然堿的化學式,討論并確定上述實驗中CO2(標準狀況)體積V(mL)與樣品質量W(g)之間的關系式。
[解析]試題以天然堿的組成及碳酸鹽的性質為依托,構筑一道有層次、有深度且思維容量較大的計算題。對信息的理解能力、對數據的觀察和處理能力是解答本題的關鍵。
(1)(672 mL/3.32 g)×2.49 g=504 mL。
(2)由題意可知,天然堿含NaHCO3、Na2CO3。
n(NaHCO3)=2n(CO2)=2×(112/22400)mol=0.01mol n(Na2CO3)=(672/22400)mol-0.01mol=0.02mol n(H2O)=[(0.45g-(112/22400)mol×18mol)/18mol=0.02mol
所以天然堿組成為2Na2CO3.NaHCO3.2H2O(式量332)。
(3)7.47 g樣品中:n(Na2CO3)=(7.47 g/332 g.mol-1)×2=0.045 mol,則:
Na2CO3完全生成NaHCO3消耗HCl:0.045mol;生成672mLCO2消耗HCl:672mL/22400 mL.mol-1=0.03 mol。故c(HCl)=(0.045 mol+0.03 mol)/0.030 L=0.025 mol/L。
(4)30ml鹽酸中n(HCl)=0.075mol,設樣品與HCl反應全轉化為NaCl,由:
2Na2CO3.NaHCO3+5HCl=5NaCl+3CO2↑+3H2O知:需樣品質量:(0.075mol/5)×332 g/mol=4.98 g
設樣品中Na2CO3與HCl反應完全轉化為NaHCO3(無CO2氣體放出),由:
(2Na2CO3.NaHCO3)+2HCl=2NaCl+3NaHCO3知:需樣品質量:(0.075mol/2)×332 g/mol=12.45g
討論:①0<W≤4.98,HCl過量:V(CO2)=(W g/332 g.mol-1×3)×22400 mL.mol-1=202.4W mL
②4.98≤W≤12.45,Na2CO3轉化NaHCO3消耗n(HCl)=(W g/332 g.mol-1)×2;剩余n(HCl)= 0.075mol-(Wg/332g.mol-1)×2,生成CO2物質的量等于剩余HCl物質的量,故V(CO2)=[0.075mol-(W g/332 g.mol-1×2)]×22400 mL/mol=(1860mL-134.9W) mL
③W≤12.45,HCl全部用于使Na2CO3轉化NaHCO3,故V(CO2)=0。
[答案](1)504 (2)2Na2CO3·NaHCO3·2H2O (3)2.5 (4)①0<W≤4.98 V(CO2)=202.4W mL或V(CO2)= (W g/332 g.mol-1×3)×22400 mL.mol-1;②4.98≤W≤12.45 V(CO2)=1680-134.9W mL或V(CO2)=[0.075mol-(W g/332 g.mol-1×2)]×22400 mL/mol;③12.45≤W V(CO2)=0
例2.(08年廣東文基·64)鐵和鐵合金是生活中常用的材料,下列說法正確的是B
A.不銹鋼是鐵合金,只含金屬元素
B.一定條件下,鐵粉可與水蒸氣反應
C.鐵與鹽酸反應,鐵合金不與鹽酸反應
D.在空氣中,鐵板比鍍鋅鐵板更耐腐蝕
[解析]本題考查了常見金屬鐵及其合金,金屬腐蝕的有關知識。鐵是一種較活波的金屬單質,在高溫的條件下可以與水蒸氣反應,A為正確選項,不銹鋼是由普通鋼中加入鉻、鎳等多種元素煉成的鋼材,里面含有C元素,B是錯項。C項鐵在氫的前面,能與鹽酸反應,鐵合金主要成分是鐵,能與鹽酸反應,是錯項,很多同學誤選這項,只看了前面的內容,后面不看。金屬的腐蝕與金屬的活波性有關,越活波,越易被腐蝕,因此D為錯項。
[答案]A
例3.(07年廣東文基·65)下列說法正確的是
A.我國流通的硬幣材質是金屬單質
B.所有的不銹鋼都只含有金屬元素
C.鎂合金的硬度和強度均高于純鎂
D.廣東正在打撈的明代沉船上存在大量鋁制餐具
[解析]有些不銹鋼中還含有碳或硅元素,故A選項錯誤;我國流通的硬幣是一種合金;合金的硬度和強度等機械性能要好于成分金屬;鋁在海洋中很容易被腐蝕。因此正確選項為C。
[答案]C
例1.(09年北京)W、X、Y、Z均為短周期元素,W的最外層電子數與核外電子總數之比為7:17;X與W同主族;Y的原子序數是W和X的原子序數之和的一半;含Z元素的物質焰色反應為黃色。下列判斷正確的是
A.金屬性:Y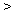 Z
B 氫化物的沸點:
Z
B 氫化物的沸點: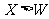
C.離子的還原性: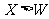 D 原子及離子半徑:
D 原子及離子半徑: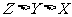
[解析]有上信息可知W、X、Y、Z分別為Cl、F、Mg、Na
[答案]B
1.從高處自由下落的物體,它的重力勢能Ep和機械能E隨高度h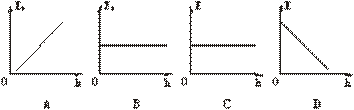 的變化圖線如圖所示,正確的是
的變化圖線如圖所示,正確的是
⒉如圖所示,小球從高處下落到豎直放置的輕彈簧上,在彈簧壓縮到最短的整個過程中,下列關于能量的敘述中正確的應是
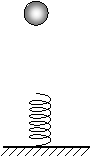 A.重力勢能和動能之和總保持不變。
A.重力勢能和動能之和總保持不變。
B.重力勢能和彈性勢能之和總保持不變。
C.動能和彈性勢能之和保持不變。
D.重力勢能、彈性勢能和動能之和總保持不變。
⒊一個質量為m的物體以a=2g的加速度豎直向上運動,則在此物體上升h的過程中,物體的
A重力勢能增加了2mgh B 動能增加了2mgh
C機械能保持不變 D機械能增加了mgh
⒋當物體克服重力做功時,物體的
A重力勢能一定減少,機械能可能不變。
B重力勢能一定增大,機械能一定增大。
C重力勢能一定減少,動能可能減小。
D重力勢能一定增大,動能可能不變。
⒌某同學身高⒈8m,在運動會上他參加跳高比賽,起跳后身體橫著越過了⒈8m高的橫桿,據此可估算出他起跳高時豎直向上的速度大約為
A 2m/S B 4m/S C 6m/S D 8m/S
⒍質量為1㎏的物體在地面上高20m的地方在一拉力的作用下以7m/㎡的加速度豎直下落5m的過程中,物體的機械能改變量是
A 5J B 10J C 15J D 20J
⒎ 如圖所示,輕質彈簧一端與墻相連,質量為4㎏的木塊沿光滑的水平面以V0=5m/S
的速度運動并壓縮彈簧K,求彈簧在被壓縮的過程中的最
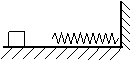 大彈性能以及木塊的速度V1=3m/S時的彈簧的彈性勢能?
大彈性能以及木塊的速度V1=3m/S時的彈簧的彈性勢能?
⒏ 氣球以10m/S的速度勻速上升,當它上升到離地15m的高空時,從氣球上掉下一個物體,若不計空氣阻力,求物體落地的速度是多少?

⒐ 質量為50㎏的跳水運動員,從1m的跳板上向上跳
起,最后以⒐8m/S的速度入水,不計空氣阻力,取g
=9.8m/S2,求 ⑴ 跳板對運動員做的功是多少?
⑵ 運動員在空中的最大高度離跳板多高?
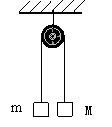
⒑一根長細繩繞過光滑的定滑輪,兩端分別系住質量為M和m的物體,且M>m,開始時用手握住M,使系統處于如圖所示的狀態,如果M下降h剛好觸地,那么m能上升的高度是多少?
[學后反思]________________________________________________________________
____________________________________________________________________________
____________________________________________________________________________
20.根據上下文,將下面一段文字補充完整。(6分)
從古至今,動物在中國人的生活觀念中有著很重要的地位,不少動物都具有豐富的象征意義。在含有動物的成語乃至熟語中,有蘊含褒揚或鼓勵意志的,如“馬到成功”,表達了對創業者的良好祝愿;又如“ ”,表達了 。也有蘊含貶斥或諷刺意味的,如“鼠目寸光”,表達了對見識淺陋者的嘲諷;又如“ ”,表達了 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com