
18.(10分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干種,依次進行下列實驗,觀察到的現象記錄如下:①加入鹽酸,有無色氣體生成;②向原溶液中滴加氯水,無氣體產生,再加CCl4振蕩,靜置,CCl4層呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,過濾;④在濾液中加AgNO3和HNO3的混合液,有白色沉淀產生.試回答:
(1)原溶液中肯定存在的離子是 ,肯定沒有的離子是 ;
(2)若步驟③改用BaCl2和鹽酸的混合溶液,對判斷(1)結論有無影響? ;
(3)步驟②中發生反應的離子方程式為 、 .
17.(6分)現有以下物質:A:Na2O2 B:Al(OH)3 C:純鹽酸 D:CaClO·Cl
E:O3 F:HF G:Fe(OH)3膠體 H:液氨
(1)屬于氧化物的是: (2)屬于混合物的是:
(3)屬于弱電解質的是: (4)屬于非電解質的是:
(5)G的制備方法用離子方程式表示:
16.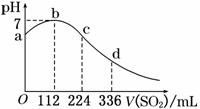 標準狀況下,某同學向100
mL H2S飽和溶液中通入SO2,所得溶液pH變化如圖所示.下列分析中,正確的是 ( )
標準狀況下,某同學向100
mL H2S飽和溶液中通入SO2,所得溶液pH變化如圖所示.下列分析中,正確的是 ( )
A.ab段反應是:SO2+2H2S===3S↓+2H2O
B.亞硫酸是比氫硫酸更弱的酸
C.原H2S溶液的物質的量濃度為0.05 mol/L
D.b點對應的溶液導電性最強
第Ⅱ卷(非選擇題 52分)
15.有BaCl2和NaCl的混合溶液a L,將它均分成兩份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反應中消耗x mol H2SO4、y mol AgNO3.據此得知原混合溶液中的c(Na+)(mol/L)為 ( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
14.常溫下,在密閉容器里分別充入兩種氣體各0.1 mol,在一定條件下充分反應后,恢復到原溫度時,壓強降低為開始時的1/4.則原混合氣體可能是 ( )
A.H2和O2 B.HCl和NH3 C.H2和Cl2 D.CO和O2
13.下列離子方程式與所述事實相符且正確的是 ( )
A.漂白粉溶液在空氣中失效:ClO-+CO2+H2O===HClO+HCO
B.用濃鹽酸與MnO2反應制取少量氯氣:
MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入過量CO2制Al(OH)3:
AlO+CO2+2H2O===Al(OH)3↓+HCO
D.在強堿溶液中次氯酸鈉與Fe(OH)3反應生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO+3Cl-+H2O+4H+
12.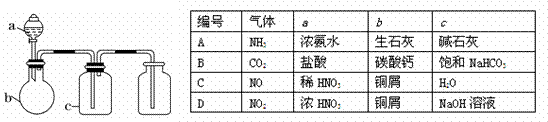 下圖中a、b、c表示相應儀器中加入的試劑,可用下圖裝置制取、凈化、收集的氣體是
下圖中a、b、c表示相應儀器中加入的試劑,可用下圖裝置制取、凈化、收集的氣體是
( )
11.下列說法正確的是 ( )
A.要氧化除去FeCl2溶液中含有I-雜質,可加入的試劑是FeCl3
B.已知:常溫時,下列三個反應都能自發的向右進行:2W-+X2===2X-+W2
2Y-+W2===2W-+Y2 2X-+Z2===2Z-+X2,則反應2Z-+Y2===2Y-+Z2
也能自發向右進行
C.NO2―→NO必須加入還原劑才能實現
D.在一定條件下,分別以高錳酸鉀、氯酸鉀、H2O2為原料制取氧氣,當制得同溫、
同壓下相同體積的氧氣時,三個反應中轉移的電子數之比為1∶1∶1
10.下列實驗操作正確的是 ( )
①用帶橡皮塞的棕色試劑瓶存放濃硫酸
②將0.1 mol/L的NaOH溶液與0.5 mol/L的CuSO4溶液等體積混合制得氫氧化銅濁液,用于檢驗醛基
③實驗室制硝基苯要把溫度計插在燒杯熱水的中部
④可用FeCl3溶液除去試管內難以刷去的銅跡
⑤欲測某溶液的pH,需先用蒸餾水潤濕pH試紙,再用潔凈、干燥的玻璃棒蘸取該溶液滴在試紙上,并與標準比色卡比較
⑥分液時,分液漏斗中下層液體從下口放出,上層液體從上口倒出
⑦蒸餾時,應使溫度計水銀球上緣與蒸餾燒瓶支管口下緣相平
A.①④ B.③④⑥⑦ C.①③ D.②④⑤
9.在兩個密閉容器中,分別充有質量相同的甲、乙兩種氣體,若兩容器的溫度和壓強均相同,且甲的密度大于乙的密度,則下列說法正確的是 ( )
A.甲的分子數比乙的分子數多
B.甲的物質的量比乙的物質的量少
C.甲的摩爾體積比乙的摩爾體積小
D.甲的相對分子質量比乙的相對分子質量小
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com