
5. 常見硅酸鹽產品比較

4. 硅及其化合物“反常”性質:
(1)硅的還原性比碳弱,但碳在高溫下卻能從SiO2中還原出硅:

這是由于生成物CO氣體逸出原因。
(2)非金屬單質與強堿反應一般不生成氫氣(請回憶Cl2)而硅卻能:

(3)雖然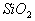 是硅酸的酸酐,但卻不能用
是硅酸的酸酐,但卻不能用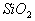 與水反應生成硅酸,而只能用硅酸鹽跟較強酸(HCl、H2CO3)制得。
與水反應生成硅酸,而只能用硅酸鹽跟較強酸(HCl、H2CO3)制得。
(4)酸性氧化物一般不與酸反應(除氧化還原反應外),而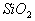 卻能與氫氟酸反應,但與其它常見酸不反應。(H2SO4、HNO3、HCl等)
卻能與氫氟酸反應,但與其它常見酸不反應。(H2SO4、HNO3、HCl等)
 (氫氟酸可腐蝕玻璃)
(氫氟酸可腐蝕玻璃)
(5)非金屬氧化物一般是分子晶體(如CO2、NO2、SO2等),而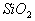 卻是原子晶體。
卻是原子晶體。
(6)無機酸一般易溶于水,而硅酸和原硅酸(H4SiO4)卻難溶于水。
(7)較強酸能把較弱酸從其鹽溶液中制取出來,這是復分解反應的一般規律,因此H2CO3可制H2SiO3: ,但在高溫下
,但在高溫下 卻能由較弱酸性氧化物制得較強酸性氧化物,其原因是,生成的CO2是氣體,離開反應體系而使反應進行到底。
卻能由較弱酸性氧化物制得較強酸性氧化物,其原因是,生成的CO2是氣體,離開反應體系而使反應進行到底。
(8)硅酸鈉的水溶液俗稱水玻璃,但它和玻璃的成分不完全相同,硅酸鈉也俗稱泡花堿,但它是鹽不是堿。
(9)鋼化玻璃與普通玻璃成份相同,石英玻璃與普通玻璃成份卻不同。
3. CO的有關知識:
(1)物理性質:
無色無味氣體,密度接近空氣,難溶于水,有劇毒。
(2)化學性質:
CO的化學性質主要是還原性,如:
 (可燃性)
(可燃性)
 (冶煉金屬)
(冶煉金屬)
2. CO2與SiO2
|
|
CO2 |
SiO2 |
|
電子式 |
 |
/ |
|
晶體類型 |
分子晶體 |
原子晶體 |
|
俗稱 |
干冰(固態時) |
硅石、石英、水晶 |
|
化學性質 |
1. 酸性氧化物    2. 弱氧化性: 2. 弱氧化性:  |
酸性氧化物 SiO2不能與水反應生成H2SiO3   |
1. 碳(金剛石為例)、硅單質的比較
列表如下:
|
|
碳 |
硅 |
|
原子結構示意圖 |
 |
 |
|
原子半徑 |
相對較小 |
相對較大 |
|
單質晶體類型 |
原子晶體(金剛石) |
原子晶體 |
|
單質熔點 |
熔點很高 |
比金剛石稍低 |
|
化學性質 |
1. 還原性: (可燃性) (可燃性)   (制粗硅) (制粗硅) (制水煤氣) (制水煤氣)2. 氧化性  |
還原性:  |
2. 硅單質、SiO2的重要性質
1. 碳單質、CO、CO2、碳酸鹽的重要性質
5. 初步了解新型無機非金屬材料,認識化學在社會、科技中的重要作用。
4. 初步了解硅酸鹽工業及其產品,認識化學與生產、生活的聯系。
3. 理解硅及其化合物的重要性質。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com