
21.(09年山東理綜·28)(14分)運用化學反應原理研究氮、氧等單質及其化合物的反應有重要意義。
(1)合成氨反應N2(g)+3H2(g) 2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡 移動(填“向左”、“向右”或“不”);使用催化劑 反應的△H(填“增大”、“減小”或“不改變”)。
2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡 移動(填“向左”、“向右”或“不”);使用催化劑 反應的△H(填“增大”、“減小”或“不改變”)。
(2)已知:O2(g) = O2+(g)+e-
 H1=1175.7
kJ·mol-1
H1=1175.7
kJ·mol-1
PtF6(g)+e-=PtF6-(g)
 H2=-771.1
kJ·mol-1
H2=-771.1
kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)
 H3=482.2
kJ·mol-1
H3=482.2
kJ·mol-1
則反應O2(g)+PtF6(g) = O2+PtF6-(s)的 H=_____________
kJ·mol-1。
H=_____________
kJ·mol-1。
(3)在25℃下,向濃度均為0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化學式),生成該沉淀的離子方程式為 。已知25℃時Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,將a mol·L-1的氨水與0.01 mol·L-1的鹽酸等體積混合,反應時溶液中c(NH4*)=c(Cl-)。則溶液顯 性(填“酸”、“堿”或“中”);用含a的代數式表示NH3·H2O的電離常數Kb= 。
答案:(1)向左 不改變
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O = Cu(OH)2↓ +2NH4+
(4)中  mol·L-1
mol·L-1
解析:(1)恒溫、恒壓條件下向平恒體系中通入氬氣,則反應體系體積增大,平衡左移;使用催化劑只是改變了反應的途徑,沒有改變反應物與生成物的狀態,△H不變;(2)利用蓋斯定律,△H1+△H2+(-△H3)= -77.6 kJ·mol-1;(3)由于,KsP [Cu(OH)2]=2.2×10-20<Ksp[Mg(OH)2]=1.8×10-11,所以先生成沉淀;2NH3·H2O+Cu2+=Cu(OH)2↓+2 NH4*;根據溶液的電中性原則,c(NH4*)=c(Cl-),則[H+]=[OH-];溶液顯中性;Kb= ,c(NH4*)=c(Cl-)=0.005 mol·L-1;[H+]=[OH-]=1×10-7 mol·L-1(因為是25℃下且為中性);[NH3·H2O]=mol·L-1-0.005 mol·L-1,則:Kb=mol·L-1。
20.
 (09年江蘇化學·17)(8分)廢舊印刷電路板的回收利用可實現資源再生,并減少污染。廢舊印刷電路板經粉碎分離,能得到非金屬粉末和金屬粉末。
(09年江蘇化學·17)(8分)廢舊印刷電路板的回收利用可實現資源再生,并減少污染。廢舊印刷電路板經粉碎分離,能得到非金屬粉末和金屬粉末。
 (1)下列處理印刷電路板非金屬粉末的方法中,不符合環境保護理念的是 (填字母)。
(1)下列處理印刷電路板非金屬粉末的方法中,不符合環境保護理念的是 (填字母)。
 A.熱裂解形成燃油 B.露天焚燒
A.熱裂解形成燃油 B.露天焚燒
 C.作為有機復合建筑材料的原料 D.直接填埋
C.作為有機復合建筑材料的原料 D.直接填埋
 (2)用H2O2和H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅。已知:
(2)用H2O2和H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+O2(g)=H2O(l) △H=-285.84kJ·mol-1
 在 H2SO4溶液中Cu與H2O2反應生成Cu2+和H2O的熱化學方程式為
。
在 H2SO4溶液中Cu與H2O2反應生成Cu2+和H2O的熱化學方程式為
。
 (3)控制其他條件相同,印刷電路板的金屬粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液處理,測得不同溫度下銅的平均溶解速率(見下表)。
(3)控制其他條件相同,印刷電路板的金屬粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液處理,測得不同溫度下銅的平均溶解速率(見下表)。
|
溫度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
銅平均溶解速率 (×10-3mol·L-1·min-1) (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
當溫度高于40℃時,銅的平均溶解速率隨著反應溫度升高而下降,其主要原因是 。
 (4)在提純后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加熱,生成CuCl沉淀。制備CuCl的離子方程式是
。
(4)在提純后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加熱,生成CuCl沉淀。制備CuCl的離子方程式是
。
 答案:(1)BD
答案:(1)BD
 (2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ.mol-1
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ.mol-1
 (3)H2O2分解速率加快
(3)H2O2分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 解析:(1)有關環保的比較容易。(2)主要考察蓋斯定律的靈活運用。適當變形,注意反應熱的計算。不要忽視熱化學方程式的書寫的注意事項。(3)考察影響化學反應速率的因素,結合雙氧水的性質即可得出答案。(4)根據題目條件書寫離子方程式常規題。
解析:(1)有關環保的比較容易。(2)主要考察蓋斯定律的靈活運用。適當變形,注意反應熱的計算。不要忽視熱化學方程式的書寫的注意事項。(3)考察影響化學反應速率的因素,結合雙氧水的性質即可得出答案。(4)根據題目條件書寫離子方程式常規題。
 [考點分析]本題考察的知識比較散,一道題考察了幾個知識點。覆蓋面比較多。但蓋斯定律,熱化學方程式,離子方程式都是重點內容
[考點分析]本題考察的知識比較散,一道題考察了幾個知識點。覆蓋面比較多。但蓋斯定律,熱化學方程式,離子方程式都是重點內容
19.(09年廣東化學·23)(11分)
磷單質及其化合物的、有廣泛應用。
(1)同磷灰石[主要成分]在高溫下制備黃磷(P4)的熱化學方程式為:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
; H
H
①上述反應中,副產物礦渣可用來 。
②已知相同條件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
 用△H1、△H2和△H3表示
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
(2)三聚磷酸可視為三個磷酸分子(磷酸結構式見右圖)之間脫去兩個水分子產物,其結構式為 。三聚磷酸鈉(俗稱“五鈉”)是常用的水處理劑,其化學式為 。
(3)次磷酸鈉(NaH2PO2)可用于化學鍍鎳。
①NaH2PO2中P元素的化合價為 。
②化學鍍鎳的溶液中含有Ni2+和H2PO2-,在酸性等條件下發生下述反應:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+
=2P+4H2PO3+3H2↑
請在答題卡上寫出并配平反應式(a)。
③利用②中反應可在塑料鍍件表面沉積鎳-磷合金,從而達到化學鍍鎳的目的,這是一種常見的化學鍍。請從以下方面比較化學鍍與電鍍。
方法上的不同點: ;原理上的不同點: ;化學鍍的優點: 。
答案:(1)水泥;△H1-3△H2+18△H3(2) ,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化學鍍中鍍件直接與電解質溶液接觸反應;電鍍通過外加電流,在鍍件外形成鍍層 ;化學鍍是利用化學腐蝕反應;電鍍是利用電解池,外加電流進行氧化還原反應 ; 裝置簡便,節約能源,操作簡便 。
,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化學鍍中鍍件直接與電解質溶液接觸反應;電鍍通過外加電流,在鍍件外形成鍍層 ;化學鍍是利用化學腐蝕反應;電鍍是利用電解池,外加電流進行氧化還原反應 ; 裝置簡便,節約能源,操作簡便 。
解析:(1)①由方程式可以看出副產物礦渣應該是CaSiO3(s),結合煉鐵我們不難得出答案是制水泥。
②運用蓋斯定律,反應1-反應2×3+反應3×18=總反應,則△H=△H1-3△H2+18△H3
(2)結合題意三聚磷酸鈉(俗稱“五鈉”)可知產物三聚磷酸應含有五個羥基,即三個
磷酸分子之間有三個羥基相互反應脫去兩個水分子,所以三聚磷酸的結構式為
 ,三聚磷酸鈉的化學式為Na5P3O10。
,三聚磷酸鈉的化學式為Na5P3O10。
(3)①因為Na、H的化合價為+1,O為-2,所以由化合價代數和為0可得P的化合價為:+1。
②由得失電子數目守恒(2-1)×2=(3-1)×1,可知Ni2+ 和Ni+的化學計量數為2,H2PO2-和H2PO3-的化學計量數為1,再由電荷守恒2×2-1=2×1-1+2×1,可知H+在方程式的右邊,H2O在方程式的左邊,化學計量數分別為2和1。即總方程式為:2Ni2+ +1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+
③比較化學鍍與電鍍應該從反應環境和條件以及反應實質和產物方面去分析歸納問題,從方法上分析,電鍍是利用電解原理通過外加直流電源,在鍍件表面形成的鍍層,鍍層一般只有鎳,而化學鍍是利用氧化還原反應鍍件直接與電解質溶液接觸,在塑料鍍件表面沉積鎳-磷合金,這是兩者的不同;從原理上分析,無論電鍍還是化學鍍均有電子的轉移,均是利用了氧化還原反應,這是兩者的相同點,不同點是化學鍍用的是化學反應,而電鍍用的是電化學;很明顯化學鍍裝置簡單,而且不需要消耗電能,裝置簡單、耗能少、操作簡便應該是化學鍍優于電鍍的。
18. (09年福建理綜·23)(15分)
(09年福建理綜·23)(15分)

 短周期元素Q、R、T、W在元素周期表中的位置如右圖所示,期中T所處的周期序數與主族序數相等,請回答下列問題:
短周期元素Q、R、T、W在元素周期表中的位置如右圖所示,期中T所處的周期序數與主族序數相等,請回答下列問題:
 (1)T的原子結構示意圖為 。
(1)T的原子結構示意圖為 。
 (2)元素的非金屬性為(原子的得電子能力):Q W(填“強于”或“弱于”)。
(2)元素的非金屬性為(原子的得電子能力):Q W(填“強于”或“弱于”)。
 (3)W的單質與其最高價氧化物的水化物濃溶液共熱能發生反應,生成兩種物質,其中一種是氣體,反應的化學方程式為 。
(3)W的單質與其最高價氧化物的水化物濃溶液共熱能發生反應,生成兩種物質,其中一種是氣體,反應的化學方程式為 。
 (4)原子序數比R多1的元素是一種氫化物能分解為它的另一種氫化物,此分解反應的化學方程式是 。
(4)原子序數比R多1的元素是一種氫化物能分解為它的另一種氫化物,此分解反應的化學方程式是 。
 (5)R有多種氧化物,其中甲的相對分子質量最小。在一定條件下,2L的甲氣體與0.5L的氯氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,所生成的R的含氧酸鹽的化學式是 。
(5)R有多種氧化物,其中甲的相對分子質量最小。在一定條件下,2L的甲氣體與0.5L的氯氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,所生成的R的含氧酸鹽的化學式是 。
 (6)在298K下,Q、T的單質各1mol完全燃燒,分別放出熱量akJ和bkJ。又知一定條件下,T的單質能將Q從它的最高價氧化物中置換出來,若此置換反應生成3molQ的單質,則該反應在298K下的
(6)在298K下,Q、T的單質各1mol完全燃燒,分別放出熱量akJ和bkJ。又知一定條件下,T的單質能將Q從它的最高價氧化物中置換出來,若此置換反應生成3molQ的單質,則該反應在298K下的 =
(注:題中所設單質均為最穩定單質)。
=
(注:題中所設單質均為最穩定單質)。
答案:(1) (2)弱于
(2)弱于
(3)S+2H2SO4(濃) 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2
 2H2O+O2↑(或其他合理答案:)
2H2O+O2↑(或其他合理答案:)
(5)NaNO2
(6)(3a – 4b)kJ/mol
解析:本題考查無機物的性質,涉及化學用語、方程式書寫、氧化還原反應以及熱化學的知識。從給出的表,結合T在周期表的位置與族數相等這一條件 ,不難得出T為Al,Q為C,R為N,W為S。(1)T為Al,13號元素。(2)S、C最高價氧化物對應的酸為硫酸強于碳酸,則可得非金屬性S強于C。(3)S與H2SO4發生歸中反應,從元素守恒看,肯定有水生成,另外為一氣體,從化合價看,只能是SO2。(4)比R質子數多1的元素為O,存在H2O2轉化為H2O的反應。(5)N中相對分子質量最小的氧化物為NO,2NO+O2=2NO2,顯然NO過量1L,同時生成1L的NO2,再用NaOH吸收,從氧化還原角度看,+2價N的NO與+4價N的NO2,應歸中生成+3N的化合物NaNO2。(6)C +O2 CO2△H=-a kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al與CO2的置換反應,寫出反應方程式為:4Al+3CO2
CO2△H=-a kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al與CO2的置換反應,寫出反應方程式為:4Al+3CO2 3C+2Al2O3,此反應的△H為可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol。
3C+2Al2O3,此反應的△H為可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol。
17. (09年安徽理綜·25)(17分)
(09年安徽理綜·25)(17分)
 W、X、Y、Z是周期表前36號元素中的四種常見元素,其原子序數一次增大。W、Y的氧化物是導致酸雨的主要物質,X的基態原子核外有7個原子軌道填充了電子,Z能形成紅色(或磚紅色)的Z2O和黑色的ZO兩種氧化物。
W、X、Y、Z是周期表前36號元素中的四種常見元素,其原子序數一次增大。W、Y的氧化物是導致酸雨的主要物質,X的基態原子核外有7個原子軌道填充了電子,Z能形成紅色(或磚紅色)的Z2O和黑色的ZO兩種氧化物。
 (1)W位于元素周期表第 周期第 族。W的氣態氫化物穩定性比
(1)W位于元素周期表第 周期第 族。W的氣態氫化物穩定性比 H2O(g)
(填“強”或“弱”)。
H2O(g)
(填“強”或“弱”)。
 (2)Y的基態原子核外電子排布式是 ,Y的第一電離能比X的 (填“大”或“小”)。
(2)Y的基態原子核外電子排布式是 ,Y的第一電離能比X的 (填“大”或“小”)。
 (3)Y的最高價氧化物對應水化物的濃溶液與Z的單質反應的化學方程式是 。
(3)Y的最高價氧化物對應水化物的濃溶液與Z的單質反應的化學方程式是 。
Fe(s)+O2(g)=FeO(s) △H=-272.0kJ·mol-1
2X(s)+O2(g)=X2O3(s) △H=-1675.7kJ·mol-1
 X的單質和FeO反應的熱化學方程式是
。
X的單質和FeO反應的熱化學方程式是
。
 答案:(1)二 VA 弱
答案:(1)二 VA 弱
 (2)1s22s22p63s23p4 大
(2)1s22s22p63s23p4 大
 (3)Cu +
2H2SO4(濃)
(3)Cu +
2H2SO4(濃) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
 (4)3FeO(s)
+ 2Al(s)
(4)3FeO(s)
+ 2Al(s) Al2O3(s) + 3Fe(s)
△H=-859.7KJ/mol
Al2O3(s) + 3Fe(s)
△H=-859.7KJ/mol
 解析:首先推出題中幾種元素,W、Y的氧化物是導致酸雨的主要物質,在結合原子序數的大小可知,W是氮元素,Y是硫元素,X的基態原子核外有7個原子軌道填充了電子,根據基態原子核外電子所遵循的原則,可以寫出電子排布式為:1s22s22p63s23p1,X為鋁元素,Z能夠形成紅色的Z2O和黑色的ZO兩種氧化物,推知Z為銅元素,兩種氧化物分別為Cu2O和CuO。
解析:首先推出題中幾種元素,W、Y的氧化物是導致酸雨的主要物質,在結合原子序數的大小可知,W是氮元素,Y是硫元素,X的基態原子核外有7個原子軌道填充了電子,根據基態原子核外電子所遵循的原則,可以寫出電子排布式為:1s22s22p63s23p1,X為鋁元素,Z能夠形成紅色的Z2O和黑色的ZO兩種氧化物,推知Z為銅元素,兩種氧化物分別為Cu2O和CuO。
16.(10分)(08年江蘇化學·18)“溫室效應”是全球關注的環境問題之一。CO2是目前大氣中含量最高的一種溫室氣體。因此,控制和治理CO2是解決溫室效應的有效途徑。
(1)下列措施中,有利于降低大氣中CO2濃度的有: 。(填字母)
a.減少化石燃料的使用 b.植樹造林,增大植被面積
c.采用節能技術 d.利用太陽能、風能
(2)將CO2轉化成有機物可有效實現碳循環。CO2轉化成有機物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2 b.CO2 + 3H2
C6H12O6+6O2 b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH
d.2CO2
+ 6H2
CH3COOH
d.2CO2
+ 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反應中,最節能的是 ,原子利用率最高的是 。
(3)文獻報道某課題組利用CO2催化氫化制甲烷的研究過程如下:

反應結束后,氣體中檢測到CH4和H2,濾液中檢測到HCOOH,固體中檢測到鎳粉和Fe3O4。CH4、HCOOH、H2的產量和鎳粉用量的關系如下圖所示(僅改變鎳粉用量,其他條件不變):

研究人員根據實驗結果得出結論:
HCOOH是CO2轉化為CH4的中間體,即:CO2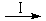 HCOOH
HCOOH CH4
CH4
①寫出產生H2的反應方程式 。
②由圖可知,鎳粉是 。(填字母)
a.反應Ⅰ的催化劑 b.反應Ⅱ的催化劑
c.反應Ⅰ、Ⅱ的催化劑 d.不是催化劑
③當鎳粉用量從1 mmol增加到10 mmol,反應速率的變化情況是 。(填字母)
a.反應Ⅰ的速率增加,反應Ⅱ的速率不變
b.反應Ⅰ的速率不變,反應Ⅱ的速率增加
c.反應Ⅰ、Ⅱ的速率均不變
d.反應Ⅰ、Ⅱ的速率均增加,且反應Ⅰ的速率增加得快
e.反應Ⅰ、Ⅱ的速率均增加,且反應Ⅱ的速率增加得快
f.反應Ⅰ的速率減小,反應Ⅱ的速率增加
答案:(10分)(1)abcd (2)a c
(3)①3Fe+4H2O Fe3O4+2H2 ②c ③e
Fe3O4+2H2 ②c ③e
解析:控制和治理CO2是解決溫室效應的有效途徑可以控制源頭,也可以吸收大氣中CO2,光合作用利用了太陽能為最節能,反應物中的原子全部轉化為有機物,為原子利用率最高。由反應原料為鐵和水,故3Fe+4H2O Fe3O4+2H2,使用催化劑可加快反應速率,根據CH4、HCOOH、H2的產量和鎳粉用量的關系圖可知,反應Ⅱ的速率均增加得快。
Fe3O4+2H2,使用催化劑可加快反應速率,根據CH4、HCOOH、H2的產量和鎳粉用量的關系圖可知,反應Ⅱ的速率均增加得快。
15.(10分)(08年江蘇化學·17)工業上制備BaCl2的工藝流程圖如下:

某研究小組在實驗室用重晶石(主要成分BaSO4)對工業過程進行模擬實驗。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
(1)氣體用過量NaOH溶液吸收,得到硫化鈉。Na2S水解的離子方程式為 。
(2)向BaCl2溶液中加入AgNO3和KBr,當兩種沉淀共存時, =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反應C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)實際生產中必須加入過量的炭,同時還要通入空氣,其目的是
, 。
答案:(10分)(1)S2-
+ H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不寫)
H2S +OH-(可不寫)
(2)2.7×10-3 (3)172.5
(4)使BaSO4得到充分的還原(或提高BaS的產量) ①②為吸熱反應,炭和氧氣反應放熱維持反應所需高溫
解析:Na2S水解實際上是二元弱酸根S2水解,因分兩步,向BaCl2溶液中加入AgNO3和KBr,當兩種沉淀共存時,兩種沉淀的平衡體系中銀離子濃度是一樣的, =[Ksp(AgBr) /Ksp(AgCl) =2.7×10-3,
反應C(s) + CO2(g)
=[Ksp(AgBr) /Ksp(AgCl) =2.7×10-3,
反應C(s) + CO2(g) 2CO(g)的△H3等于△H1減去△H2。實際生產中必須加入過量的炭,同時還要通入空氣,其目的是炭和氧氣反應放熱維持反應所需高溫來維持反應①②所需熱量。
2CO(g)的△H3等于△H1減去△H2。實際生產中必須加入過量的炭,同時還要通入空氣,其目的是炭和氧氣反應放熱維持反應所需高溫來維持反應①②所需熱量。
14.(12分)(08年山東理綜·29)北京奧運會“祥云”火炬燃料是丙烷(C3H8),亞特蘭大奧運會火炬燃料是丙烯(C3H6)。
(1)丙烷脫氫可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
則相同條件下,反應C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷為燃料制作新型燃料電池,電池的正極通入O2和CO2,負極通入丙烷,電解質是熔融碳酸鹽。電池反應方程式為 ;放電時CO32-移向電池的 (填“正”或“負”)極。
(3)碳氫化合物完全燃燒生成CO2和H2O。常溫常壓下,空氣中的CO2溶于水,達到平衡時,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的電離及H2CO3的第二級電離,則H2CO3 HCO3-+H+的平衡常數K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常數K1=
。(已知10-5.60=2.5×10-6)
(4)常溫下,0.1 mol·L-1NaHCO3溶液的pH大于8,則溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用離子方程式和必要的文字說明)。
答案:
(1)124.2
(2)C3H8+5O2=3CO2+4H2O 負
(3)4.2×10-7 mol·L-1
(4)> HCO3-+H2O=CO32-+H3O+(或HCO3-=CO32-+H+)、HCO3-+H2O=H2CO3+OH-,HCO3-的水解程度大于電離程度
解析:(1)將第2個方程式顛倒反寫,然后與第1個方程式相加,即得所求的反應C3H8(g)====CH3CH=CH2 (g)+H2(g),△H也隨方程式的變化關系進行求算:△H=-△H2+△H1=124.2kJ.mol-1。
(2)以丙烷為燃料制作的新型燃料電池,其電池反應方程式為C3H8十502=3C02+4H20,因電子從電池的負極經導線流入了電池的正極,故電池的正極是電子富集的一極,故帶負電荷的離子C032-在電解質溶液中應移向電池的負極而不是正極。
(3)根據電離平衡常數公式可知:
K1=c(H+)c(HCO3-)/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol. L-1。
(4)0.1 mol L-1NaHCO3溶液的pH大于8,說明溶液呈堿性,即c(OH-)>c(H+),因在NaHCO3溶液中存在著兩個平衡:電離平衡HCO3-
 CO32-+H+,水解平衡: HC03-+H20
CO32-+H+,水解平衡: HC03-+H20

 H2CO3-+OH-
,其余部分水的電離忽略不計,由c(OH-)>c(H+),說明水解過程大于電離過程,從而推出c(H2CO3)>c(CO32-)
。
H2CO3-+OH-
,其余部分水的電離忽略不計,由c(OH-)>c(H+),說明水解過程大于電離過程,從而推出c(H2CO3)>c(CO32-)
。
13.(11分)(08年廣東化學·19)
碳酸鈉是造紙、玻璃、紡織、制革等行業的重要原料。工業碳酸鈉(鈍度約98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等雜質,提純工藝路線如下:

已知碳酸鈉的溶解度(S)隨溫度變化的曲線如下圖所示:
 回答下列問題:
回答下列問題:
(1)濾渣的主要成分為 。
(2)“趁熱過濾”的原因是 。
(3)若在實驗室進行“趁熱過濾”,可采取的措施是
(寫出1種)。
(4)若“母液”循環使用,可能出現的問題及其原因是 。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=+473.63 kJ·mol-1
寫出Na2CO3·H2O脫水反應的熱化學方程式 。
答案:(1)Mg(OH)2、Fe(OH)3、CaCO3
(2)使析出的晶體為Na2CO3·H2O,防止因溫度過低而析出Na2CO3·10H2O晶體,令后續的加熱脫水耗時長
(3)用已預熱的布氏漏斗趁熱抽濾
(4)溶解時有大量沉淀生成,使Na2CO3損耗且產物Na2CO3混有雜質 其原因:"母液"中,含有的離子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,當多次循環后,使用離子濃度不斷增大,溶解時會生成CaSO4,Ca(OH)2,CaCO3等沉淀
(5)Na2CO3·H2O(s)=== Na2CO3(s) + H2O(g)△H= +58.73kJ·mol-1
解析:
(1) 因工業碳酸鈉中含有Mg2+,Fe3+,Ca2+,所以“除雜”中加入過量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
(2) 觀察坐標圖,溫度減少至313K時發生突變,溶解度迅速減少,弱不趁熱過濾將析出晶體。
(3) 思路方向:1.減少過濾的時間 2.保持過濾時的溫度。
(4) 思路:分析“母液”中存在的離子,若參與循環,將使離子濃度增大,對工業生產中哪個環節有所影響。
(5) 通過觀察兩個熱化學方程式,可將兩式相減,從而得到Na2CO3·H2O(S)====== Na2CO3(s)+ H2O(g)。
12. (07年山東理綜·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大氣的主要污染物。綜合治理其污染是環境化學當前的重要研究內容之一。
(07年山東理綜·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大氣的主要污染物。綜合治理其污染是環境化學當前的重要研究內容之一。
(1)硫酸生產中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某溫度下,SO2的平衡轉化率(a)與體系總壓強(p)的關系如右圖所示。根據圖示回答下列問題:
①將2.0mol SO2和1.0mol O2置于10L密閉容器中,反應達平衡后,體系總壓強為0.10MPa。該反應的平衡常數等于_____。
②平衡狀態由A變到B時.平衡常數K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化還原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用標準狀況下4.48L CH4還原NO2至N2整個過程中轉移的電子總數為______(阿伏加德羅常數的值用NA表示),放出的熱量為______kJ。
(3)新型納米材料氧缺位鐵酸鹽(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni=由鐵酸鹽(MFe2O4)經高溫還原而得,常溫下,它能使工業廢氣中的酸性氧化物分解除去。轉化流程如圖所示:


請寫出MFe2Ox分解SO2的化學方程式 (不必配平)。
答案:(1)①800L·mol-1 ②= (2)1.60NA(或1.6NA) 173.4 (3)MFe2Ox+SO2→MFe2O4+S
解析:(1)據題意當容器中總壓強為0.10MPa時,SO2的平衡轉化率為0.80,據此可計算得出平衡時c(SO2)=0.040mol·L-1;c(O2)=0.020mol·L-1;c(SO3)=0.16mol·L-1。根據平衡常數的計算式:K= =800L·mol-1;只要溫度不變,平衡常數就不改變,在此變化過程中,只有壓強的改變,溫度未發生變化,故K(A)=K(B)。
=800L·mol-1;只要溫度不變,平衡常數就不改變,在此變化過程中,只有壓強的改變,溫度未發生變化,故K(A)=K(B)。
(2)用標準狀況下4.48LCH4還原NO2 至N2,4.48LCH4的物質的量為0.20mol,在此過程中CH4中碳元素的化合價有-4價升高到+4價,轉化為CO2,失去電子的總物質的量為0.20mol×8= 1.60mol,故轉移電子數為1.60NA。由題目給知的熱化學方程式,根據蓋斯定律可以得出CH4還原NO2至N2的熱化學方程式為:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1,則0.2molCH4反應放出的熱量為867 kJ·mol-1×0.2mol=173.4kJ。
(3)此題中反應物已知為MFe2OX和SO2,反應后生成MFe2O4,由MFe2OX轉化為MFe2O4,氧原子數增加,故SO2失去氧原子轉化為S,反應式為:MFe2OX+SO2=MFe2O4+S。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com