
1.原電池和電解池的比較:
|
裝置 |
原電池 |
電解池 |
|
實例 |
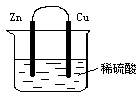 |
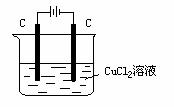 |
|
原理 |
|
|
|
形成條件 |
①電極:兩種不同的導體相連; ②電解質溶液:能與電極反應。 |
①電源; ②電極(惰性或非惰性); ③電解質(水溶液或熔化態(tài))。 |
|
反應類型 |
自發(fā)的氧化還原反應 |
非自發(fā)的氧化還原反應 |
|
電極名稱 |
由電極本身性質決定: 正極:材料性質較不活潑的電極; 負極:材料性質較活潑的電極。 |
由外電源決定: 陽極:連電源的正極; 陰極:連電源的負極; |
|
電極反應 |
負極:Zn-2e-=Zn2+ (氧化反應) 正極:2H++2e-=H2↑(還原反應) |
陰極:Cu2+ +2e- = Cu (還原反應) 陽極:2Cl--2e-=Cl2↑ (氧化反應) |
|
電子流向 |
|
|
|
電流方向 |
|
|
|
能量轉化 |
|
|
|
應用 |
①抗金屬的電化腐蝕; ②實用電池。 |
①電解食鹽水(氯堿工業(yè));②電鍍(鍍銅);③電冶(冶煉Na、Mg、Al);④精煉(精銅)。 |
2.知道電解在氯堿工業(yè)、精煉銅、電鍍、電冶金等方面的應用。認識電能轉化為化學能的實際意義。
知識梳理
1.通過電能轉變?yōu)榛瘜W能的探究活動,了解電解池工作原理,能正確書寫電解池的陰、陽極的電極反應式及電解反應方程式。
2. 原電池的原理
負極----較活潑的金屬--- 電子------發(fā)生 反應
正極----較不活潑的金屬---- 電子----發(fā)生 反應
試題枚舉
[例1]下列敘述中正確的是
A.構成原電池正極和負極的材料必須是兩種金屬。
B.由銅、鋅作電極與硫酸銅溶液組成的原電池中銅是負極。
C.馬口鐵(鍍錫鐵)破損時與電解質溶液接觸錫先被腐蝕。
D.銅鋅原電池工作時,若有13克鋅被溶解,電路中就有0.4mol電子通過。
解析: 兩種活動性不同的金屬與電解質溶液能夠組成原電池,但不能因此說構成原電池電極的材料一定都是金屬,例如鋅和石墨電極也能跟電解質溶液組成原電池。在原電池中,活動金屬中的電子流向不活動的電極,因此活動金屬是負極。鍍錫鐵表皮破損后與電解質溶液組成原電池,鐵較錫活潑,鐵先失電子被腐蝕。銅鋅原電池工作時,鋅負極失電子,電極反應為Zn –2e==Zn2+,1molZn失去2mol電子,0.2mol鋅(質量為13克)被溶解電路中有0.4mol電子通過。故選D。
答案:D
[例2]把A、B、C、D四塊金屬泡在稀H2SO4中,用導線兩兩相連可以組成各種原電池。若A、B相連時,A為負極;C、D相連,D上有氣泡逸出;A、C相連時A極減輕;B、D相連,B為正極。則四種金屬的活潑性順序由大到小排列為
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
解析:金屬組成原電池,相對活潑金屬失去電子作負極,相對不活潑金屬作正極。負極被氧化質量減輕,正極上發(fā)生還原反應,有物質析出,由題意得活潑性 A>B、A>C、C>D 、D>B,故正確答案為B。
答案:B
[例3]電子計算機所用鈕扣電池的兩極材料為鋅和氧化銀,電解質溶液為KOH溶液,其電極反應是: Zn + 2 OH- -2e=ZnO + H2O Ag2O +H2O + 2e=2Ag +2 OH-
下列判斷正確的是
A.鋅為正極,Ag2O為負極。 B.鋅為負極,Ag2O為正極。
C.原電池工作時,負極區(qū)溶液PH減小。 D.原電池工作時,負極區(qū)溶液PH增大。
解析:本題考查原電池和PH的概念。
原電池中失去電子的極為負極,所以鋅為負極,Ag2O為正極。B是正確答案。因為 Zn + 2 OH- -2e=ZnO + H2O ,負極區(qū)域溶液中[OH-] 不斷減少,故PH減小,所以C也正確。故選B、C。
答案:BC
[變式]化學電池在通訊、交通及日常生活中有著廣泛的應用。
(1)目前常用的鎳(Ni)鎘(Cd)電池,其電池總反應可以表示為:Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均難溶于水但能溶于酸,
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均難溶于水但能溶于酸,
以下說法中正確的是
①以上反應是可逆反應 ②以上反應不是可逆反應
③充電時化學能轉變?yōu)殡娔堋 ?④放電時化學能轉變?yōu)殡娔?/p>
A.①③ B.②④ C.①④ D.②③
(2).廢棄的鎳鎘電池已成為重要的環(huán)境污染物,有資料表明一節(jié)廢鎳鎘電池可以使一平方米面積的耕地失去使用價值。在酸性土壤中這種污染尤為嚴重。這是因為
。
(3).另一種常用的電池是鋰電池(鋰是一種堿金屬元素,其相對原子質量為7),由于它的比容量(單位質量電極材料所能轉換的電量)特別大而廣泛應用于心臟起搏器,一般使用時間可長達十年。它的負極用金屬鋰制成,電池總反應可表示為:Li+MnO2→LiMnO2試回答:鋰電池比容量特別大的原因是 。鋰電池中的電解質溶液需用非水溶劑配制,為什么這種電池不能使用電解質的水溶液?請用化學方程式表示其原因 。
答案:(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液。
(3)鋰的摩爾質量小;2Li+2H2O→2LiOH+H2↑
電解池原理
考點聚焦
2.能正確書寫原電池的正、負極的電極反應式及電池反應方程式。
知識梳理
1:組成原電池的條件。
① 有兩種活性不同的金屬(或一種是非金屬導體)。
② 電極材料均插入電解質溶液中。
③ 兩電極相連形成閉合電路。
1.通過進行化學能轉化為電能的探究活動,了解原電池工作原理.
①不能與H+共存的離子有 、
②不能與OH-共存的離子有 、
③不能與HCO3-共存的離子有 、
④不能與Al3+共存的離子有 、
⑤不能與AlO2-共存的離子有 、
⑥不能與Fe3+共存的離子有 、
⑦不能與Fe2+共存的離子有 、
⑧不能與ClO-共存的離子有 、
試題枚舉
[例1] (2006江蘇,13)下列敘述正確的是
A.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液與10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的體積為20 mL,則溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸強堿鹽NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
解析:NH3·H2O是弱電解質,它本身電離所產生的兩種離子濃度相等,得氨水中的部分OH-來自于H2O的電離,所以c(OH-)>c(NH4+),A錯;B項中酸堿中和反應后,
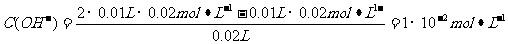
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正確;根據(jù)鹽的消解規(guī)律,可以判斷C正確;D項中因鈉元素的離子與A原子的物質的量之比為1∶1,對應關系應該為c(Na+)=c(A2-)+c(HA-)+c(H2A),D錯。
答案:BC
[例2] (2006四川,12)25℃時,將稀氨水逐滴加入到稀硫酸中,當溶液的PH=7時,下列關系正確的是
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
解析: 氨水與稀硫酸反應,至溶液呈中性,即c(H+)=c(OH-);根據(jù)電荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),則D錯;將前兩個等式融合得, c(NH4+)=2c(SO42-),則A錯,B對,C錯。
答案: B
[例3] 已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,則下列說法正確的是( )
A.在Na2A、NaHA兩溶液中,離子種類不相同
B.在溶質物質的量相等的Na2A、NaHA兩溶液中,陰離子總數(shù)相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
解析:0.1 mol·L-1的強酸pH=1.0,0.1
mol·L-1的H2A溶液pH=4.0,說明它是一種弱酸。Na2A發(fā)生水解A2-+H2O HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA發(fā)生水解HA-+H2O
H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA發(fā)生水解HA-+H2O H2A+OH-和電離HA-
H2A+OH-和電離HA- H++A2-,溶液中存在HA-、A2-、H+、OH-,所以兩溶液中離子種類相同,A不正確。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以兩溶液中離子種類相同,A不正確。
物質的量相等的Na2A和NaHA因為存在上述水解、電離等過程,陰離子數(shù)量發(fā)生變化,所以陰離子總量不相等,B不正確。
由電荷守恒可知c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),C正確。Na2A溶液顯堿性,c(OH-)>c(H+),D不正確。
答案: C
[例4] 化合物SOCl2是一種液態(tài)化合物,沸點77 ℃。在盛有10 mL水的錐形瓶中,小心地滴加8-10滴SOCl2,可觀察到劇烈反應,液面上有白霧形成,并有帶刺激性氣味的氣體逸出。該氣體可使滴有品紅試液的濾紙褪色。輕輕振蕩錐形瓶,等白霧消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳狀沉淀析出。
(1)根據(jù)上述實驗,寫出SOCl2和水反應的化學方程式:________________。
(2)AlCl3溶液蒸干灼燒得不到無水AlCl3,而用SOCl2與AlCl3·6H2O混合共熱,可得到無水AlCl3,原因是________________。
解析:水解的本質是化合物中帶正電的基團結合水中電離產生的OH-,而帶負電部分結合水中電離產生的H+。據(jù)題給信息分析,產生的刺激性氣體應是SO2,它是由SO2+結合OH-轉化成H2SO3,而另一帶負電的Cl-結合水電離的H+生成HCl,與AgNO3反應生成白色的AgCl沉淀。
答案: (1)SOCl2+H2O====SO2↑+2HCl
(2)因為蒸干AlCl3溶液時,由于AlCl3水解生成的HCl易揮發(fā),而得到Al(OH)3,但當與SOCl2混合共熱時,由于SOCl2極易吸水,防止了AlCl3的水解,有關的化學方程式為6SOCl2+AlCl3·6H2O====6SO2↑+AlCl3+12HCl
[例5]用酚酞、石蕊、0.1mol/L氨水、氯化銨晶體、0.1mol/L鹽酸、熟石灰和蒸餾水,若僅用上述試劑怎樣用簡單實驗方法證明氨水是弱堿?并指出是通過什么途徑證明氨水是弱堿的?
解析:證明氨水是弱堿,可通過兩條途徑:一是證明氨水中存在電離平衡,如方案(1)。另一是證明NH4+作為弱堿陽離子能破壞水的電離平衡發(fā)生水解反應,如方案(2)、(3)。
答案: 方案(1)取少量氨水,滴加酚酞,溶液呈紅色,然后向其中加人少量CH3COONH4晶體,振蕩,可看到紅色變淺,說明氨水中存在電離平衡,氨水為弱堿。
方案(2)取少量NH4Cl晶體溶于水,滴加石蕊試液,溶液顯紅色,說明NH4+水解生成了NH3·H2O和HCl,從而破壞了水的電離平衡,亦說明氨水是弱堿。
方案(3)將 0.1mol/L NH3· H2O與0.1mol/L鹽酸等體積混合,再滴加石蕊試劑,溶液顯紅色,說明NH4+水解破壞了水的電離平衡,從而說明氨水是弱堿。
[變式]解釋說明化學事實:向盛有少量Mg(OH)2 懸濁液培養(yǎng)皿中加入適量的飽和氯化銨溶液。現(xiàn)象
討論解釋其原因:同學甲:實驗中存在Mg(OH)2的溶解、結晶平衡: Mg(OH)2(固) 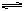 Mg2++2OH-。當加入NH4Cl時,由于NH4+水解,NH4++H2O
Mg2++2OH-。當加入NH4Cl時,由于NH4+水解,NH4++H2O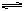 NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,從而使溶液中[OH-]減小,促進Mg(OH)2溶解,使溶液澄清。同學乙:實驗中加入NH4Cl后,溶液中NH4+可與OH-結合從而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同學的兩種解釋誰的更有道理?
通過實驗來進一步驗證:
。為什么乙更合理?
NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,從而使溶液中[OH-]減小,促進Mg(OH)2溶解,使溶液澄清。同學乙:實驗中加入NH4Cl后,溶液中NH4+可與OH-結合從而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同學的兩種解釋誰的更有道理?
通過實驗來進一步驗證:
。為什么乙更合理?
答案: Mg(OH)2溶解,使溶液澄清;乙同學的解釋合理;向盛有少量Mg(OH)2懸濁液的培養(yǎng)皿中加入CH3COONH4 固體,觀察懸濁液是否變澄清。CH3COONH4屬弱酸弱堿鹽,雖強烈水解但溶液呈中性。同時,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2沒有溶解,說明甲同學的解釋正確。若Mg(OH)2溶解,則說明乙同學的解釋正確;因為Mg(OH)2比 NH3· H2O的堿性強。
Ⅰ.判斷溶液的酸堿性: ;
Ⅱ.判斷不同弱電解質的相對強弱: ;
Ⅲ.比較溶液中離子濃度:
①同一溶液中不同離子濃度: 、
②不同溶液中相同離子濃度: 。
Ⅳ.解釋某些化學現(xiàn)象及在生產生活中的應用: 。
。
⑴電荷守恒:電解質溶液中陰、陽離子所帶的正、負電荷數(shù)相等,即溶液不顯電性。如磷酸溶液中,c (H+)= c (OH-)+ c(H2PO4-)+2 c(HPO42-)+3 c(PO43-)
⑵物料守恒:就是電解質溶液中某一組分的原始濃度(起始濃度)應該等于它在溶液中各種存在形式的濃度之和。如0.1mol/L的NaHS溶液,0.1= c (HS-)+ c (S2-)+ c (H2S)或
c (Na+)= c (HS-)+ c (S2-)+ c (H2S)
⑶原理守恒:水電離的特征是c (H+)= c (OH-),據(jù)此可以得出下列關系如在K2CO3溶液中:c (OH-)= c (H+)+ c (HCO3-)+2(H2CO3)(也稱質子守恒)
例題:分別以①H2S②NaHS③Na2S為例離子濃度的守恒關系:
⑴物料守恒① 、
② ③
⑵電荷守恒:① ②
③ ;
⑶質子守恒:① ②
③ 。
①多元弱酸溶液,根據(jù)多步電離分析,如在H3PO4的溶液中,c (H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
②多元弱酸的正鹽溶液根據(jù)弱酸根的分步水解分析,如Na2CO3的溶液中,c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)
③不同溶液中同一離子濃度的比較,要看溶液中其他離子對其影響的因素。如在相同的物質的量濃度的下列各溶液中a、NH4Cl b、CH3COONH4 c、NH4HSO4。c(NH4+)由大到小的順序是 c>a>b。
④ 混合溶液中各離子濃度的比較,要進行綜合分析,如電解因素、水解因素等。
分別以H2S、NaHS、Na2S為例:
①離子濃度的大小比較:H2S 、NaHS 、Na2S 。
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com