
15、(2010·成都模擬)某核素R原子核內中子數比質子數多43,由它組成的固體單質A,在一定條件下密度為6.88g·cm-3,用X射線研究其固體表明,在邊長為1.0×10-7cm3的立方體中含有20個原子。R的+4價化合物在溶液中具有強氧化性,可將NO2氧化為HNO3。請回答:
(1)R原子的摩爾質量為 (取整數)。
(2)R元素的核電荷數為 ,處于周期表中第 周期 族,其元素符號為 。
(3)溶液中不存在R4+,假若能使少量R4+加到FeCl2溶液中,是否會發生反應?
若“否”,其原因為: 。(若“是”,則不答)
若“是”,其離子反應方程式為: 。(若“否”,則不答)
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在鋼鐵表面,有利于形成耐腐蝕的鈍化層。已知R3O4與足量的HNO3反應,生成R的氧化物、R的硝酸鹽和水三種物質,此反應的離子方程式為:
[答案](1)207g/mol (2)82 6 ⅣA Pb
(3)Pb4++2Fe2+= Pb2++2Fe3+ (4)Pb3O4+4H+=PbO2+2Pb2++2H2O
()
14、(2010·上海徐匯區模擬)已知20℃時,CO2密度為1.83g/L,Ca(OH)2的溶解度為0.165g/100g H2O。20℃時,將NaOH和Ca(OH)2的混合物2.02 g全部溶于897g水中配制成稀溶液,再緩緩通入CO2氣體(不考慮溶解過程中溶質之間溶解性的相互影響)。
計算:(計算結果精確到0.01)
(1)20℃時,CO2的氣體摩爾體積為____________________L/mol;
(2)若消耗369mL CO2氣體時,生成沉淀的質量剛好達到最大,求原混合物中NaOH的質量。
(3)若在上述溶液中緩緩通入CO2氣體,使其充分反應,理論上消耗CO2的總體積為VmL,則V的取值范圍為 。
[答案](1)24.04; (2)1.28g
(3)1214.02<V<1286.14
13、(2010·惠州模擬)(1)有一包白色固體粉末,可能由Na2CO3 和NaHCO3,請設計實驗確定該白色粉末的成分(用化學方程式表示): 。
(2)現有純堿溶液、酚酞溶液、氯化鈣溶液,請設計一個探究純堿溶液呈堿性是由CO32-引起的實驗方案,寫出主要實驗步驟及實驗現象:
。
[解析] 第一問比較簡單,只需要根據CO3 2-和HCO3-的區別選擇不同的方法即可檢驗出結果;第二問中探究實驗的關鍵在于設計有無CO3 2-的對比實驗,根據實驗現象的對比即可確認純堿溶液呈堿性是由CO32-引起的,而除去CO3 2-的方法通常有兩種,即沉淀法和生成氣體法,結合題目所給出的試劑,顯然只能采取沉淀法。
[答案](1)Na2CO3+BaCl2=BaCO3↓+2NaCl(合理答案即可)
(2)用試管取少量純堿溶液,向純堿溶液中滴加酚酞溶液,溶液顯紅色;若再向該溶液中滴入過量氯化鈣溶液,產生白色沉淀,且溶液紅色褪去。說明純堿溶液呈堿性是由CO32-引起的。
12、(2010·邵陽模擬)已知A、B、C、D組成的元素都屬于短周期,它們之間的簡單轉化關系如圖所示。請按要求寫出有關反應的化學方程式:
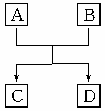
(1)若其中A、D為單質且同主族,B、C為氧化物: (該反應在工業上有重要用途) 。
(2)若A、D為常態下的氣體單質且不同主族,B、C為化合物且B為水: 。
(3)若A、B、C均為化合物且C為水,單質D常態下為固體: 。
(4)若A、B、C均為氧化物,D為單質,反應是在高溫下進行: 。
(5)若A、D為固體單質且不同主族,B、C為氧化物: 。
[解析]無機框圖題是歷年高考化學試題的重要組成部分,這類題涉及知識面廣,要求學生有較高的邏輯思維能力。以短周期元素為重點。本題較綜合地考查了學生對中學化學中常見的置換反應類型,中學化學階段所涉及的置換反應類型通常有非金屬置換非金屬、金屬置換金屬、金屬置換非金屬、非金屬置換金屬四種類型,常見的有Fe2O3+2Al2Fe+Al2O3、4H2O(g)+ 3FeFe3O4+4H2、2Mg+CO2 2MgO+C、H2O(g)+ C CO+H2、SiO2+2C 2CO↑+Si、2F2+2H2O4HF+ O2、2H2O+ 2Na2NaOH+H2↑、H2(或C或CO)+CuO Cu+ H2O等;
Cu+ H2O等;
[答案](1)2C+SiO22CO+Si
(2)2F2+2H2O===4HF+O2或2Cl2+2H2O4HCl+O2
(3)SO2+2H2S===3S+2H2O
(4)CO+H2O(g)CO2+H2
(5)2Mg+CO22MgO+C
11、(2010·蘇州模擬)已知25℃、101kPa下,石墨、金剛石燃燒的熱化學方程式分別為:
C(石墨)+O2(g) =CO2(g);△H=-393.51kJ·mol-1
C(金剛石)+O2(g) =CO2(g);△H=-395.41kJ·mol-1”,則下列結論正確的是 ( )
A.在該條件下金剛石比石墨穩定,等質量時金剛石的能量大于石墨
B.金剛石轉化為石墨為放熱反應
C.石墨轉化為金剛石為物理變化
D.由于石墨轉化為金剛石為吸熱反應,因此石墨在任何條件下都不可能轉化為金剛石
[解析]選B。本題考查化學反應中的能量規律及其應用。用下一反應減去上一反應可得:C(金剛石) =C(石墨) △H=-1.9kJ·mol-1”,說明等質量時金剛石的能量大于石墨,A項錯誤;金剛石轉化為石墨為放熱反應,B項正確;石墨轉化為金剛石為化學變化,C項錯誤;石墨在一定條件下可能轉化為金剛石,D項錯誤。
10、(2010·臨沂模擬)向飽和Na2CO3溶液中通入足量CO2,結果有晶體析出,對析出晶體的原因分析錯誤的是 ( )
A.相同溫度下,Na2CO3的溶解度大于NaHCO3 B.溶液中溶劑減少了 C.溶質質量增加了 D.反應過程放熱
[解析]選D。產生沉淀的原因不是產生的碳酸氫鈉不溶于水,而是因為碳酸氫鈉溶液達到了飽和,不能溶解的碳酸氫鈉沉淀了下來。從化學方程式中可以算出,如果有106克碳酸鈉參加反應的話,可以生成168克碳酸氫鈉.因為原溶液是"飽和"的碳酸鈉,反應過程中又消耗了一部分的水。且同溫度下,碳酸鈉的溶解度要大于碳酸氫鈉,所以產生的碳酸氫鈉無法全部溶解.就產生了沉淀,D項不正確。
9、(2010·長沙模擬)20世紀80年代后,人們發現和證實了碳的另一類單質,它們是由一系列偶數個碳原子組成的分子,其中C60(足球烯,分子中含有30個雙鍵)最具代表性。下圖所示為n個C60連接而成的物質X。下列有關說法不正確的是( )
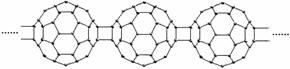
A.X難溶于水 B.一定條件下X可與H2發生加成反應
C.X是碳的一種同素異形體 D.X的摩爾質量為720g
[答案]選D。碳的單質均難溶于水,A項正確;因為該物質含有雙鍵,一定條件下X可與H2發生加成反應,B項正確;C60是碳元素的一種單質,與金剛石、石墨互為同素異形體,C項正確;C60的摩爾質量應為720g/mol,D項錯誤。
8、(2010·鄭州模擬)一種新型材料B4C,它可用于制作切削工具和高溫熱交換器。關于B4C的推斷正確的是 ( )
A.B4C是一種分子晶體 B.B4C是一種離子晶體
C.B4C是一種原子晶體 D.該分子是有4個硼原子和1個碳原子構成
[解析]選C。由題意可得該物質硬度大、耐高溫符合原晶體的性質,C項正確。
7、(2010·重慶模擬)已知(OCN)2的電子式為 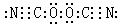 ,則SCN– 的電子式正確的是( )
,則SCN– 的電子式正確的是( )
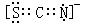
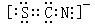 A.
B.
A.
B.
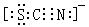
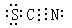 C.
D.
C.
D.
[解析]選D。
6、(2010·鄭州模擬)碳與它非相鄰的短周期元素以極性鍵形成的化合物中,各原子最外層都達到了8電子穩定結構。滿足這種關系的元素共有( )
A.3種 B.4種 C.5種 D.6種
[解析]選B。CO2,CF4,CS2,CCl4均符合題意,B項正確。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com