
21.(8分)把0.6 mol X氣體和0.6 mol Y氣體混合于2 L體積不變的密閉容器中,使它們發生如下反應:2X(g)+ Y(g)===nZ(g)+2W(g)。2 min末已生成0.2 mol W,若測知以Z的濃度變化表示的反應速率為0.1 mol·(L·min)-1。
計算:(1)n的值;
(2)前2min內用X的濃度變化表示的平均反應速率。
宿遷市2008-2009學年度普通中學第一次四校聯考
20.(10分)下圖是實驗室制乙烯并進而合成1,2-二溴乙烷裝置
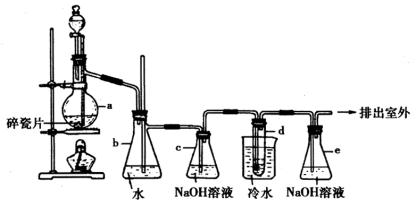
其中,a中裝有乙醇和濃硫酸的混合液,d中裝有液溴。填寫下列空白:
(1)a中發生的化學反應為:________________。
(2)b裝置的作用是:①________________,②________________。
(3)c中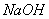 溶液的作用是________________。
溶液的作用是________________。
(4)d中發生的化學反應為:________________。
(5)1,2-二溴乙烷收率很低的原因是:①________________,②________________。
19.(10分)某課外興趣小組對H2O2的分解速率做了如下實驗探究。
⑴下表是該小組研究影響過氧化氫(H2O2)分解速率的因素時采集的一組數據:
用10mL H2O2制取150mLO2所需的時間(秒)
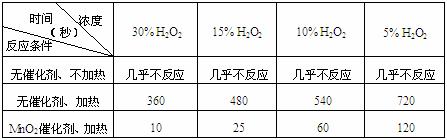
①該研究小組在設計方案時。考慮了濃度、 、 等因素對過氧化氫分解
速率的影響。
②從上述影響過氧化氫分解速率的因素中任選一個,說明該因素對分解速率有何影響?
。
⑵將質量相同但聚集狀態不同的MnO2分別加入到5mL 5%的雙氧水中,并用帶火星的木
條測試。測定結果如下:
|
催化劑(MnO2) |
操作情況 |
觀察結果 |
反應完成所需的時間 |
|
粉末狀 |
混合不振蕩 |
劇烈反應,帶火星的木條復燃 |
3.5分鐘 |
|
塊狀 |
反應較慢,火星紅亮但木條未復燃 |
30分鐘 |
①寫出H2O2發生的化學反應方程式_______________ _________。
②實驗結果說明催化劑作用的大小與________ ________________有關。
⑶若已知1 克液態過氧化氫分解成氧氣和液態水時,可放出2.89kJ能量,寫出該反應的熱化學方程式: 。
18.(8分)(1)烴完全燃燒生成二氧化碳和水。若以CxHy表示任意烴,試寫出CxHy完全燃燒的化學方程式:
(2)用化學方程式表示:
①苯與濃硫酸、濃硝酸混合制備硝基苯:
②乙烯與氯氣的加成反應
③丙烯(CH2=CH-CH3)和溴水
。
17.(12分)下表標出的是元素周期表的一部分元素,回答下列問題:
(1)表中用字母標出的14種元素中,化學性質最不活潑的是_________________(用元素符號表示,下同),金屬性最強的是_____________,非金屬性最強的是 ___________,屬于過渡元素的是________________(該空用字母表示)。
(2)I和F的最高價氧化物對應的水化物的化學式分別為 、 (填化學式)。
(3)除稀有氣體外第三周期中原子半徑最小的是_________________(填元素符號)。
(4)寫出D的最高價氧化物電子式 ;D的氣態氫化物的結構式 。
(5)A,F,N的氫化物中沸點最高的是 (填化學式)。
16.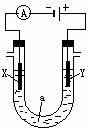 (14分)電解原理在化學工業中有廣泛應用。右圖表示一個電解池, 裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
(14分)電解原理在化學工業中有廣泛應用。右圖表示一個電解池, 裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩
邊各滴入幾滴酚酞試液,則
①電解池中X極上的電極反應式為 。在X極附近觀察到
的現象是 。
②Y電極上的電極反應式為 ,檢驗該電極反應產物的方
法是 。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是 ,電極反應式為 。
②Y電極的材料是 ,電極反應式為 。 (說明:雜質發生的電極反應不必寫出)
|
1 |
|
|
|
|||||||||||||||
|
2 |
|
|
|
|
D |
|
B |
A |
|
|||||||||
|
3 |
J |
I |
H |
|
C |
G |
F |
E |
||||||||||
|
4 |
L |
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
5 |
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.(10分)現有①BaCl2 ②金剛石 ③ 金屬銅 ④KOH ⑤干冰 ⑥固態氮氣⑦二氧化硅⑧白磷⑨K2O⑩NH4Br六種物質,按下列要求回答(填序號):
⑴熔化時需要破壞共價鍵的是________;⑵既含有共價鍵又含有離子鍵的是 ;
⑶屬于共價分子單質的是 ;⑷屬于金屬晶體的是_____ _______ ;
⑸寫出⑤的電子式 ,
14.哈伯因發明氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎。現向一密閉容器中充入1mol N2和3mol H2,在一定條件下使該反應發生。下列有關說法正確的是
A.達到化學平衡時,N2不能完全轉化為NH3
B.達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等
C.達到化學平衡時,正反應和逆反應的速率都為零
D.達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化
非 選 擇 題(共72分)
13.下列說法正確的是
A.NO、NO2互為同素異形體
B.相同溫度下冰的密度比水小,與水分子間的氫鍵有關
C.水分子間存在氫鍵使水分子間作用力增加,導致水的沸點較高
D.化學鍵是指物質中相鄰的原子或離子間的強烈的吸引作用
12.一定條件下反應N2(g)+3H2(g)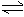 2NH3(g
)在10L的密閉容器中進行,測得2min內,N2的物質的量由20mol減小到8mol,則2min內N2的反應速率為
2NH3(g
)在10L的密閉容器中進行,測得2min內,N2的物質的量由20mol減小到8mol,則2min內N2的反應速率為
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com