
例1. 下列關系圖中,A是一種正鹽,B是氣態氫化物,C是單質,F是強酸。當X無論是強酸還是強堿時都有如下轉化關系(其他產物及反應所需條件均已略去),當X是強堿時,B跟Cl2反應除生成C外,另一產物是鹽酸鹽。
用化學式號填寫下列空格:

(1)A是__________。
(2)當X是強酸時,A、B、C、D、E、F均含同一種元素,F是__________。
(3)當X是強堿時,A、B、C、D、E、F均含同一種元素,F是__________。
(4)B跟Cl2反應的化學方程式是_______。
[解析]正鹽A能與強酸反應生成氣態氫化物,則A中含無氧酸根即非金屬陰離子。該非金屬單質可被O2連續兩次氧化,分別生成兩種氧化物,故A中含S2-。其轉化過程是:
S2- H2S
H2S S
S SO2
SO2 SO3
SO3 H2SO4
H2SO4
又因為正鹽A能與強堿反應生成氣態氫化物,則A中含NH4+。氣態氫化物NH3中氮被Cl2置換后生成的HCl又與NH3化合成NH4Cl。其轉化過程是:
NH4+ NH3
NH3 N2
N2 NO
NO NO2
NO2 HNO3
HNO3
[答案](1)(NH4)2S (2)H2SO4 (3)HNO3
(4)H2S+Cl2=2HCl+S↓;8NH3+3Cl2=N2+6NH4Cl
例2:如下圖所示的轉化關系
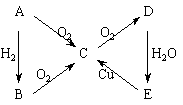
已知A為單質,試判斷A、B、C、D、E各是什么物質,寫出分子式。
|
|
A |
B |
C |
D |
E |
|
A為氣體時 |
|
|
|
|
|
|
A為固體時 |
|
|
|
|
|
[解析]根據歸納出的“特征網絡”:(1)A B
B C
C D(酸或堿),結合題目中“E
D(酸或堿),結合題目中“E C”,能與Cu反應的是酸,且只有HNO3和濃H2SO4,即可推斷出結果。
C”,能與Cu反應的是酸,且只有HNO3和濃H2SO4,即可推斷出結果。
[答案]N2、NH3、NO、NO2、HNO3;S、H2S、SO2、SO3、H2SO4;
例3.下圖是無機物A-M在一定條件下的轉化關系(部分產物及反應條件未列出)。其中,I是由第三周期元素組成的單質中熔點最高的金屬,K是一種紅棕色氣體。

請填寫下列空白:
(1)在周期表中,組成單質G的元素位于第__________周期_________族。
(2)在反應⑦中氧化劑與還原劑的物質的量之比為___________________。
(3)在反應②、③、⑥、⑨中,既屬于化合反應又屬于非氧化還原反應的是_________
(填寫序號)。
(4)反應④ 的離子方程式是:_______________________________________
( 5 )將化合物D 與KNO3、KOH 共融,可制得一種“綠色”環保高效凈水劑K2FeO4 (高鐵酸鉀).同時還生成KNO2和H2O 。該反應的化學方程式是:____________________________。
解析:解推斷題的關鍵是找“題眼”。K是一種可由氧氣與L反應得到的紅棕色氣體,可推知K是NO2,再推出J溶液為硝酸溶液。由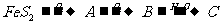 可推知A為SO2,B為SO3,C為H2SO4,由FeS2的煅燒可知D為鐵的氧化物,由反應⑤⑥可推出:E為Fe(OH)3,
可推知A為SO2,B為SO3,C為H2SO4,由FeS2的煅燒可知D為鐵的氧化物,由反應⑤⑥可推出:E為Fe(OH)3,
D為Fe2O3,結合I是由第三周期元素組成的單質中熔點最高的金屬,可得I為Al,根據鋁熱反應及題中信息G為單質得G為Fe,H為Al2O3,,則M為Fe(NO3)2或Fe(NO3)3,又M能與C溶液反應(H2SO4)反應,則M只能是Fe(NO3)2。
答案:(1)四(或4);Ⅷ (2)1:2 (3)③ (4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
21. 氯化亞銅(CuCl)是重要的化工原料。國家標準規定合格的CuCl產品的主要質量指標為CuCl的質量分數大于96.50%。工業上常通過下列反應制備CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制備過程中需要配置質量分數為20.0%的CuSO4溶液,試計算配置該溶液所需的CuSO4·5H2O與H2O的質量之比。
⑵準確稱取所配置的0.2500g CuCl樣品置于一定量的0.5mol·L-1 FeCl3溶液中,待樣品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到終點,消耗24.60mLCe(SO4)2溶液。有關反化學反應為
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通過計算說明上述樣品中CuCl的質量分數是否符合標準。
20.已知: 4NH3十5O2 → 4NO+6H2O
4NO十3O2十2H2O→4HNO3
設空氣中氧氣的體積分數為0.20,氮氣體積分數為0.80,請完成下列填空及計算
(1)amolNO完全轉化為HNO3需要氧氣_______ mol
(2)為使NH3恰好完全氧化為一氧化氮,氨-空氣混合物中氨的體積分數為________ (保留2位小數)。
(保留2位小數)。
(3)20.0moL的NH3用空氣氧化,產生混合物的組成為:NO18.0mol、O212.0 mol、N2150.0 mol和一定量的硝酸,以及其它成分。(高溫下NO和O2不反應) 計算氨轉化為NO和HNO3的轉化率。
(4) 20.0moL 的NH3和一定量空氣充分反應后,再轉化為HNO3
①在下圖中畫出HNO3的物質的量n(A)和空氣的物質的量n(B)關系的理論曲線。
②寫出當125≤n(B) ≤ 200時,n(A)和n(B)的關系式_________________________________。

19.合成氨工業生產中所用的α-Fe催化劑的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,鐵、氧的物質的量之比為4︰5,其中Fe2+與Fe3+物質的量之比為___________。
(2)當催化劑中Fe2+與Fe3+的物質的量之比為1︰2時,其催化活性最高,此時鐵的氧化物混合物中鐵的質量分數為_____________(用小數表示,保留2位小數)。
 (3)以Fe2O3為原料制備上述催化劑,可向其中加入適量炭粉,發生如下反應:
(3)以Fe2O3為原料制備上述催化劑,可向其中加入適量炭粉,發生如下反應:
2 Fe2O3十C 4FeO十CO2↑。為制得這種活性最高的催化劑,應向480g Fe2O3粉末中加入炭粉的質量為_________g。
18.鈷(Co)化合物對化學鍵的研究起著重要的作用。為測定某鈷化合物[Co(NH3)xCly]Clz的組成,進行如下實驗:
①稱取樣品0.5010g,加入過量的NaOH溶液,煮沸,蒸出所有的氨,冷卻,得到A。產生的氨用50.00mL0.5000mol·L-1的鹽酸完全吸收并用蒸餾水定容至100mL,得溶液B。取B溶液20.00mL, 用0.1000mol·L-1NaOH滴定,消耗NaOH溶液30.00mL。
②向A中加入過量KI固體,振蕩,鹽酸酸化后置于暗處,發生反應:Com++I-→Co2++I2 (未配平)
反應完成后,蒸餾水稀釋,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1Na2S2O 3溶液20.00mL。反應方程式為:I2+2Na2S2O3==2NaI+Na2S4O6
3溶液20.00mL。反應方程式為:I2+2Na2S2O3==2NaI+Na2S4O6
③另稱取該物質樣品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反應完全,消耗AgNO3溶液20.00mL。相應反應式為:
[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
通過 計算求:⑴[Co(NH3)xCly]Clz中氮元素的質量分數。
計算求:⑴[Co(NH3)xCly]Clz中氮元素的質量分數。
⑵該鈷化合物的化學式。
17.地球化學中,通常用熱重分析研究礦物在受熱時的質量變化以確定其組成。取66.6mg由高嶺石[Al4Si4O10(OH)8]和方解石(CaCO3)組成的礦物,加熱,在673K-1123K區間內分解為氧化物,樣品總失重13.8mg。
⑴方解石的失重百分比為 。
⑵計算礦物中高嶺石的質量分數。
16. 將一定質量的鎂和鋁的混合物投入100 mL鹽酸中,固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示。若不考慮金屬和鹽酸反應時HCl的揮發,則下列說法正確的是(
)
將一定質量的鎂和鋁的混合物投入100 mL鹽酸中,固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示。若不考慮金屬和鹽酸反應時HCl的揮發,則下列說法正確的是(
)
A.鎂和鋁的總質量為9 g
B.鹽酸的物質的量濃度為5 mol·L-1
C.NaOH溶液的物質的量濃度為5 mol·L-1
D.生成的氫氣在標準狀況下的體積為11.2 L
15.有 Na2CO3、NaHCO3、CaO 和 NaOH的混合物27.2 g, 把它們溶于足量水并充分反應后,HCO3-、CO32-、Ca2+均轉化為沉淀,將容器內水分蒸干后得到固體物質共29 g,則原混合物中含Na2CO3 ( )
A.0.1 mol B.0.2 mol C.0.3mol D.無法確定
14.5 mL Ag+濃度為0.1 mol·L-1的某溶液,加入等物質的量的某種堿金屬鹽,待鹵化物完全沉淀后,經過濾、干燥,稱得質量為0.013 g,則此沉淀是( )
A.LiF B.LiCl C.AgF D.AgCl
13.在天平兩盤中各放一只大小和質量相同的燒杯,兩燒杯中都盛有1 mol/L的稀硫酸100 mL,然后分別向兩燒杯中加入一定質量的Mg與Al,充分反應后天平仍保持平衡,則Mg、Al的質量分別是( )
A.2.4 g Mg 1.8 g Al B.5 g Mg 5 g Al C.2 g Mg 2 g Al D.0.9697 g Mg 1 g Al
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com