
1. 若命題“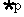 ”與命題“
”與命題“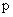 或
或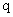 ”都是真命題, 那么命題
”都是真命題, 那么命題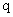 一定是
. 命題 (填寫
一定是
. 命題 (填寫
“真”或“假”)
2.根式的運算性質:
①當n為任意正整數時,(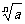 )
)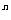 =a.
=a.
②當n為奇數時, =a;當n為偶數時,
=a;當n為偶數時, =|a|=
=|a|= .
.
⑶根式的基本性質: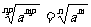 ,(a
,(a 0).
0).
1.根式的概念;
例1(課本第71頁 例1)求值
① = -8 ;
= -8 ;
② = |-10| =
10 ;
= |-10| =
10 ;
③ = |
= |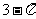 | =
| =  ;
;
④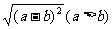 = |a- b| =
a- b .
= |a- b| =
a- b .
去掉‘a>b’結果如何?
例2求值:

分析:(1)題需把各項被開方數變為完全平方形式,然后再利用根式運算性質;
 解:
解:

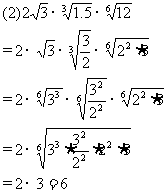

1.根式:
⑴計算(可用計算器)
①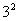 = 9 ,則3是9的平方根 ;
= 9 ,則3是9的平方根 ;
②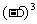 =-125 ,則-5是-125的立方根 ;
=-125 ,則-5是-125的立方根 ;
③若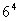 =1296 ,則6是1296 的 4次方根 ;
=1296 ,則6是1296 的 4次方根 ;
④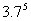 =693.43957 ,則3.7是693.43957的5次方根 .
=693.43957 ,則3.7是693.43957的5次方根 .
⑵定義:
一般地,若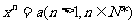 則x叫做a的n次方根
則x叫做a的n次方根
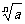 叫做根式,n叫做根指數,a叫做被開方數
叫做根式,n叫做根指數,a叫做被開方數
例如,27的3次方根表示為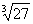 ,-32的5次方根表示為
,-32的5次方根表示為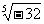 ,
,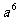 的3次方根表示為
的3次方根表示為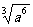 ;16的4次方根表示為!
;16的4次方根表示為!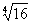 ,即16的4次方根有兩個,一個是
,即16的4次方根有兩個,一個是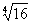 ,另一個是-
,另一個是-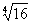 ,它們絕對值相等而符號相反.
,它們絕對值相等而符號相反.
⑶性質:
①當n為奇數時:正數的n次方根為正數,負數的n次方根為負數
記作: 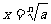

②當n為偶數時,正數的n次方根有兩個(互為相反數)
記作: 

③負數沒有偶次方根,
④ 0的任何次方根為0
注:當a 0時,
0時,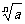
 0,表示算術根,所以類似
0,表示算術根,所以類似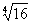 =2的寫法是錯誤的.
=2的寫法是錯誤的.
⑷常用公式
根據n次方根的定義,易得到以下三組常用公式:
①當n為任意正整數時,(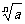 )
)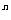 =a.例如,(
=a.例如,(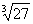 )
)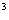 =27,(
=27,(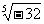 )
)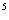 =-32.
=-32.
②當n為奇數時, =a;當n為偶數時,
=a;當n為偶數時, =|a|=
=|a|= .
.
例如, =-2,
=-2,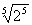 =2;
=2;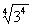 =3,
=3, =|-3|=3.
=|-3|=3.
⑶根式的基本性質: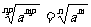 ,(a
,(a 0).
0).
注意,⑶中的a 0十分重要,無此條件則公式不成立. 例如
0十分重要,無此條件則公式不成立. 例如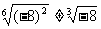 .
.
用語言敘述上面三個公式:
⑴非負實數a的n次方根的n次冪是它本身.
⑵n為奇數時,實數a的n次冪的n次方根是a本身;n為偶數時,實數a的n次冪的n次方根是a的絕對值.
⑶若一個根式(算術根)的被開方數是一個非負實數的冪,那么這個根式的根指數和被開方數的指數都乘以或者除以同一個正整數,根式的值不變.
3.注意
①
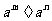 可看作
可看作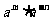 ∴
∴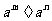 =
=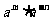 =
=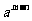

②
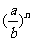 可看作
可看作 ∴
∴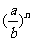 =
= =
=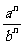

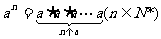
2.運算性質:
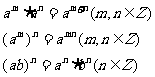

1.整數指數冪的概念

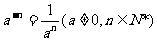

4、 叫做中和熱。
試題枚舉
[例1]已知反應A+B=C+D為放熱反應,對該反應的下列說法中正確的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的總能量一定高于C和D的總能量
D. 該反應為放熱反應,故不必加熱就一定能發生
解析:化學反應中的能量變化,通常主要表現為熱量的變化--吸熱或放熱,當反應物的總能量高于生成物質總能量時為放熱反應中,當反應物的總能量低于生成物的總能量時為吸熱反應。值得注意的是:總能量是指所有反應物或所有生成物,而不是其中某些反應物或某些生成物,所以A、B是不正確的;而有的放熱反應在開始時也是需要加熱的,例如炭的燃燒。
答案:C
[例2]關于吸熱反應的說法正確的是( )
A.凡需加熱的反應一定是吸熱反應 B.只有分解反應才是吸熱反應
C.使用催化劑的反應是吸熱反應
D.CO2與CaO化合是放熱反應,則CaCO3分解是吸熱反應
解析:A組見上一題目分析,有些化合反應也是吸熱反應,例如炭和二氧化碳化合生成一氧化碳的反應就是吸熱反應,故B不正確,催化劑是用來改變化學反應速率的,它不能改變反應物和生成自身的能量,故不影響反應熱,像合成氨、二氧化硫的催化氧化都是放熱反應,故C也是不對的。CO2和CaO的化合反應與CaCO3的分解反應是相反過程,故D正確。
答案D
[例3]下列反應屬于吸熱反應的是( )
A.Ba(OH)2•8H2O晶體和NH4Cl混合攪拌 B.鹽酸和氫氧化鈉混合
C.鋅放入稀硫酸中 D.焦炭和水蒸氣高溫下反應
解析: 酸與堿的中和反應、金屬與酸的反應都是放熱反應。
答案:AC
[變式]下列說法正確的是( )
A.需要加熱才能發生的反應一定是吸熱反應
B.任何放熱反應在常溫條件下一定能發生反應
C.反應物和生成物所具有的總能量決定了反應結果是放熱還是吸熱
D.吸熱反應在一定條件下也能發生反應
答案:C
[例4]在氫氣與氯氣反應生成氯化氫氣體的反應中,若斷裂1mol H - H鍵要吸收436KJ的能量,斷裂1mol Cl- Cl鍵要吸收243KJ的能量,斷裂1molH-Cl鍵要吸收432KJ的能量,則在氯氣中充分燃燒1mol H2 的能量變化是 。
解析: 在氯氣中充分燃燒1mol H2 時,要先破壞1mol的H-H鍵和1mol的Cl-Cl鍵,此過程是需要吸收679kJ的能量;在氯氣中充分燃燒1mol H2 時會形成2molH-Cl,放出864KJ的能量,吸收和放出能量相抵,仍會放出185KJ的能量。
答案:185kJ
[變式]把煤作為燃料可通過下列兩種途徑:
途徑Ⅰ:C(s)+O2(g) CO2(g) (
放熱Q1 kJ )
CO2(g) (
放熱Q1 kJ )
途徑Ⅱ:先制水煤氣
C(s)+H2O(g) == CO(g)+H2(g) (吸熱Q2 kJ)
再燃燒水煤氣
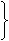
|
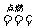 2CO2(g)
2CO2(g)
2H2(g)+O2(g) 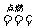 2H2O(g)
2H2O(g)
試回答下列問題:
(1)判斷兩種途徑放熱:途徑Ⅰ放出的熱量_________(填“大于”、“等于”或“小于”)途徑Ⅱ放出的熱量。
(2)Q1、Q2、Q3的數學關系式是__________________。
(3)由于制取水煤氣反應里,反應物所具有的總能量________生成物所具有的總能量,那么在化學反應時,反應物就需要_______能量才能轉化為生成物,因此其反應條件為______ 。
(4)簡述煤通過途徑Ⅱ作為燃料的意義:
[答案](1)等于 (2)Q1 = Q3 - Q2 (3)低于 吸收 高溫
(4) 固體煤經處理變為氣體燃料后,不僅在燃燒時可以大大減少SO2和煙塵對大氣造成的污染,而且燃燒效率高,也便于輸送 。
3.化學反應中物質的化學能除了轉變為熱能,還可以轉變為電能,那么請問:什么樣的化學反應中的化學能才能轉變為電能呢?又是如何轉化的?
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com