
6.(2005年·山東青島)某化學活動小組以“酸堿鹽的性質”為主題,進行探究學習,請你做為該小組成員來解決下列問題:
(1)小剛同學說:“酸溶液呈酸性,堿溶液呈堿性,則鹽溶液一定呈中性”。你認為這種推理 (填“正確”或“不正確”),你的例證是 。
(2)小麗同學從某一欠收農田里取回一份土壤樣品,請你用兩種不同的方法幫小麗測出該土壤樣品浸出液的酸堿性(只寫出所用試劑的名稱即可):
① ;② 。
如果檢測的結果呈酸性,那么要改良此土壤,應該向農田里施加 。
(3)請你設計一個實驗,能通過清晰可見的現象,除去氯化鈣溶液中的少量稀鹽酸。你的實驗方案是(寫出實驗操作、現象和結論):
5.(2005年·江西省)用兩根玻璃棒分別在濃氨水和濃鹽酸中蘸一下,然后將這兩根玻璃棒靠近(不要接觸,如下圖),可觀察到產生大量白煙。這種白煙是氨氣和氯化氫氣體化合生成的微小氯化銨晶體,請完成:
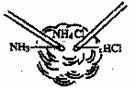
(1)寫出該反應的化學方程式_______________________________
(2)從這個實驗你能獲得的信息是(任寫兩點)
、 。
4.(2005年·江蘇宿遷)(1)用pH試紙測定溶液的pH時,正確的操作是: 。
(2)小華同學用pH試紙,按正確操作測定洗發劑和護發劑的pH。測得洗發劑的pH略大于7,則洗發劑顯 性;測得護發劑的pH略小于7,則護發劑顯 性。
(3)弱酸性有益于頭發的健康。想一想,洗發時應先用 劑,后用 劑。
3.(2005年·北京海淀)下列四組物質中,其中按酸、堿、鹽順序排列的是( )
A.鹽酸、碳酸鈉、硫酸鋇 B.碳酸氫鈉、氫氧化鈣、氯化鈉
C.氯化鈉、氫氧化鈉、硫酸 D.硫酸、氫氧化鈣、碳酸鈉
2.(2005年·江蘇海門)下圖表示的是身邊一些物質的近似pH。有關這些物質的比較和判斷正確的是( )

A.醋的酸性比醬油弱 B.西瓜汁顯中性
C.肥皂水的堿性最強 D.蘋果汁顯堿性
1.(2005年·遼寧大連)某洗滌劑的pH為12,向其中滴入2滴酚酞試液,溶液的顏色呈( )
A.紅色 B.紫色 C.藍色 D.無色
3.對以中和反應為原理的化學計算,忽視對基本計算題型的方法選擇、步驟格式、數字處理等。
對涉及到中和反應的試題,要注意對以下細微的知識點的積累和理解:①概念問題:如對酸堿中和反應的理解以及中和反應產物-鹽的理解;對溶液酸堿性和酸堿度的區別;②實驗問題:如對酸堿中和反應的實驗探究、溶液pH的測定的實驗操作等;③應用問題:如對酸堿中和反應在實際中的應用、溶液酸堿度在實際中的意義等;④計算問題:以中和反應為原理的計算,要將中和反應和常見的計算題的呈現形式和常規題型結合起來;⑤綜合問題:如將酸堿中和反應和溶液pH值的變化相結合,綜合考查化學計算和圖像分析的能力。
[基礎演練]
2.忽視對中和反應多角度、多層次的認識,如對有關中和反應的發生與否以及程度大小的探究不能結合中和前后溶液的酸堿性和化學性質進行實驗方案的設計;對中和反應前后溶液的pH變化不能根據溶液成分的變化進行分析和推斷。
對中和反應的認識要從多方面進行,例如氫氧化鈉溶液和鹽酸的中和反應:NaOH+HCl=NaCl+H2O,可以從反應物的定量關系進行認識,這是化學計算的基礎;從實驗現象改進進行認識,這是實驗探究和方案設計的基礎;從實際中的應用進行認識等等。
1.忽視對基本概念的理解和區別,如酸性溶液和酸溶液、堿溶液和堿性溶液、溶液的酸堿性和酸堿度等易混淆概念。不注重易混淆概念的區別,很容易出現知識的錯誤遷移,如根據“酸溶液呈酸性,堿溶液呈堿性”推導出“鹽溶液呈中性”;根據酸“在水溶液中能解離出H+和酸根離子”推導出“在水溶液中能解離出H+的是酸”(如NaHSO4=Na++H++SO42-)。
5.以酸堿中和反應的原理為載體,考查化學計算的能力,如例5;
[典例精析]
例1:(2005年·廣東汕頭)下表是常用物質的主要成分及其溶液的pH:
|
編號 |
① |
② |
③ |
④ |
|
常用物質 |
食醋 |
白酒 |
石灰水 |
純堿 |
|
主要成分 |
CH3COOH |
C2H5OH |
Ca(OH)2 |
Na2CO3 |
|
pH |
3 |
7 |
11 |
10 |
請按下列要求將表中對應物質的編號填入空格處:
(1)屬于酸的是_____________,屬于堿的是___________,屬于鹽的是___________。
(2)黃蜂毒刺呈堿性,若某人被黃蜂蜇了,可用上述____________物質涂在皮膚上。
解析 本題要求根據常用物質的主要成分和溶液的pH對物質類別進行判斷。在判斷時不能僅僅根據溶液的pH進行判斷,因為酸溶液的pH<7,堿溶液的pH<7,但鹽溶液的pH不一定等于7,還要結合物質的主要成分。
答案:(1)①,③,④(2)①
例2:(2005年·甘肅蘭州) 甲、乙、丙分別是酸或堿的水溶液,pH值依次為1,5,14。下列圖形合理的是( )
A.圖(1)表示甲中滴入丙 B.圖(2)表示乙中滴入丙
C.圖(3)表示丙中滴入乙 D.圖(4)表示甲中滴入乙
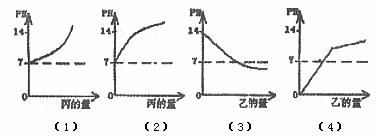
解析 根據甲、乙、丙溶液的pH可以判斷出分別為酸、酸、堿。甲中滴入丙,pH逐漸變大,但小于14;乙中滴入丙,pH逐漸變大,但小于14;丙中滴入乙,pH逐漸減小,但大于5;甲中滴入乙,pH逐漸變大,但始終小于5。
答案:C
例3:(2005年·江西省課改實驗區)如圖所示,小娟同學在進行酸堿中和反應的實驗時,向燒杯的氫氧化鈉溶液滴加稀鹽酸一會兒后,發現忘記了滴加指示劑。為了確定鹽酸與氫氧化鈉是否恰好完全反應,小娟從燒杯中取少量反應后的溶液于一支試管中,并向試管中滴加幾滴無色酚酞試液,振蕩,觀察到酚酞試液不變色。于是她得出“兩種物質已恰好完全中和”的結論。
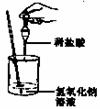
(1)你認為她得出的結論是否正確_____ ;理由是
______________________________
(2)寫出該中和反應的化學方程式___________ ____ __。
(3)請你另設計一個實驗,探究上述燒杯中的溶液是否恰好完全中和,填寫下表:
|
實驗方法 |
可能觀察到的現象 |
結論 |
|
|
|
|
解析 本題要求設計實驗對鹽酸和氫氧化鈉發生中和反應的程度(即鹽酸加入量的多少)進行判斷。在進行實驗設計時可結合中和前后溶液的酸堿性變化或者主要成分,利用酸堿指示劑或者酸、堿的性質進行中和反應程度的判斷。鹽酸和氫氧化鈉恰好中和或者鹽酸過量的區別在于中和后溶液的成分和酸堿性不同。顯然小娟的結論不正確,
答案:(1)不正確 如果鹽酸過量,滴如酚酞也不會變色(2)NaOH+HCl=NaCl+H2O(3)(以下方法任寫一種均可得分)
|
①取樣,滴加紫色石蕊試液 |
試液變紅 |
鹽酸過量 |
|
②取樣,滴加紫色石蕊試液 |
試液不變紅 |
恰好中和 |
|
③取樣,滴加碳酸鈉溶液 |
有氣泡產生 |
鹽酸過量 |
|
④取樣,滴加碳酸鈉溶液 |
無氣泡產生 |
恰好中和 |
|
⑤取樣,加入鋅粒等活潑金屬 |
有氣泡產生 |
鹽酸過量 |
|
⑥取樣,加入鋅粒等活潑金屬 |
無氣泡產生 |
恰好中和 |
例4:(2005年·廣東汕頭)胃酸的主要成分是鹽酸,胃酸過多會引起胃痛。下圖是一種治療胃病藥物的標簽。

請回答:
(1)該藥物的主要作用是_________________,這種藥物在胃中發生反應的化學方程式是______________________________________。
(2)胃痛時吃幾塊蘇打餅干(含純堿)可減輕胃痛,該反應的化學方程式是:_________________________________________________________。
解析 本題考查了酸堿中和反應的實際應用-治療胃病。根據該藥物的標簽標明的主要成分,可以判斷出藥物的作用為中和胃酸。胃痛時服用蘇打餅干減輕胃痛是利用鹽酸和蘇打的反應較少胃中胃酸的量。
答案:中和胃液中過多的鹽酸 Al(OH)3+3HCl=AlCl3+3H2O(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑
例5:(2005年·廣東茂名)人胃酸(主要成分是鹽酸)過多,會引起很胃病。下圖為某抗酸藥包裝標簽上的部分文字,請回答下列問題。

(1)該藥“嚼啐后吞服”的原因是___________________。
(2)某同學為測定該藥中氫氧化鋁的質量分數進行如下操作:取一片藥片(藥片質量為0.5g)研碎后加20mL蒸餾水,然后用質量分數為5%,密度為1.02g/mL的鹽酸進行反應(假充其它成分不與鹽酸反應),測得實驗中反應掉的鹽酸體積為6.0mL,通過計算:
①判斷該藥片中氫氧化鋁的含量是否達到標注?
②確定該藥片中氫氧化鋁的質量分數是多少?
解析 本題以抗酸藥中成分含量測定為載體,考查了酸堿中和反應在實際中的應用和化學計算的能力。將藥物“嚼啐后吞服”,主要是增大反應物的接觸面積,加快與胃酸作用。
設藥片中氫氧化鋁質量為x。根據測定的化學反應:Al(OH)3+3HCl=AlCl3+3H2O,結合反應消耗的鹽酸的量,有:78:3×36.5=x:1.02g/ml×6.0ml×5%
解得x=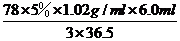 =0.218g
=0.218g
因為氫氧化鋁的實際質量為218mg,小于標簽所標識的250mg。故藥品中的氫氧化鋁含量沒有達到標準。
藥品中氫氧化鋁的質量分數為: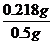 ×100%=43.6%。
×100%=43.6%。
答案:(1)增大反應物的接觸面積,加快與胃酸作用(2)①沒有達到標準②43.6%
[常見誤區]
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com