
⑶ 3Fe+4H2O(g)
 Fe3O4+4H2
(2分)
Fe3O4+4H2
(2分)
【解析】NaCl溶液涉及的工業生產為侯氏制堿,G為NaHCO3,H為Na2CO3,I為NH4Cl。A是一種含兩種元素組成的液態有機溶劑,A和B反應前后氣體體積(常溫常壓)保持不變,A為CS2,B為氧氣,反應CS2+3O2=CO2+2SO2反應前后氣體體積不變,所以C為CO2,D為SO2,式量關系M(SO2)= Fe3O4+4H2。圖為銅和硫酸反應制H2不能自發完成,故反應只有通過電解才可能完成。銅作陽極,硫酸為電解質溶液。
Fe3O4+4H2。圖為銅和硫酸反應制H2不能自發完成,故反應只有通過電解才可能完成。銅作陽極,硫酸為電解質溶液。
【答案】⑴CS2(2分)
⑵ NaCl+CO2+H2O+NH3 NaHCO3↓+NH4Cl(2分) 聯合制堿法或侯氏制堿法(1分)
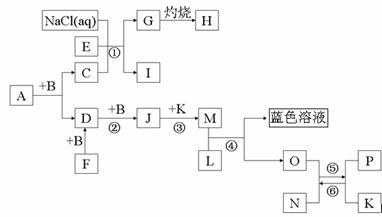
⑴A的化學式___________。
⑵寫出反應①的化學方程式_______________________________。
在工業上叫______________
⑶高溫下反應⑤⑥互為可逆反應,寫出反應⑥的化學方程式___________________
(4)寫出在加熱條件下單質F與單質L的化學反應方程式___________________________。
(5)請設計一個實驗方案,完成反應④,并在答題卡指定位置繪出實驗裝置圖。
(3)
3Fe+4H2O(g)  Fe3O4+4H2
(3分)
Fe3O4+4H2
(3分)
(4) 加少量KClO3,插上鎂條并將其點燃(2分),
焊接鋼軌(制高熔點金屬)(其他合理答案也給分)(2分)
(5) 2H2O+2e-=2OH-+H2↑(3分)
【原創7】(14分)已知A是一種含兩種元素組成的液態有機溶劑,N帶有磁性,B、F、L、O、P是中學化學常見單質, B、D、F、J都含有一種相同的元素且它們的相對分子質量關系是M(D)=
【原創6】 (15分)物質之間的轉化關系如下圖,其中A、D、E、F、H為常見單質,其余為化合物,且單質E和單質F在點燃或加熱的條件下生成淡黃色的固體,B常溫下為液態化合物。 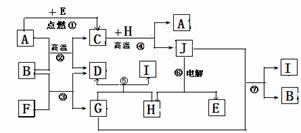
試回答下列有關問題:
(1)A在元素周期表的位置 周期 族
(2)以上7個化學反應屬于非氧化還原反應的是 (用編號①→⑦填寫)
(3)寫出反應①是 ;
(4)寫出引發反應④的實驗操作
寫出該反應一種重要的工業用途
(5)反應⑤的化學方程式是 。
(5)寫出用A與H作電極材料插入G溶液閉合電路后的正極反應式是 。
【解析】此題明顯的突破口單質E和單質F在點燃或加熱的條件下生成淡黃色的固體,馬上知道是Na202,說明E、F一定為Na 和02。結合反應②條件是高溫,馬上就推出,E是02,F是Na(Na活潑不需要高溫)。結合由B常溫下為液態化合物,推出B為是水,D為H2,G為NaOH。反應⑤與NaOH反應產生氫氣的單質中學階段只有Al和Si,結合⑥電解推出H為Al,J為Al2O3。由反應②高溫條件下產生氫氣體的單質有Fe和C,結合反④高溫條件得到Al2O3,那只有A是Fe。驗證反應⑦符合條件。寫出用Fe與Al作電極材料插入電解溶液NaOH ,總方程式是:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,總方程式減去負極反應式2Al+8OH--6e-=2AlO2-+4H2O即為正極反應式:6H2O+6e-=6OH-+3H2↑。
【答案】(1) 四 Ⅷ(2分)
(2) ⑦(2分)
6.乙炔的應用:焊接和切割金屬。
5.漂白粉的制備、漂白原理、失效原理;
4.鋁熱反應的原理、引發操作、應用;
3.圍繞水開發試題:堿金屬(Na、k)、堿土金屬(Ca)等與水反應,堿金屬(Na、k)、堿土金屬(Ca)的過氧化物與水反應,鹵素與水的反應(特別注意F2的特殊性),NO2與水反應,電石與水反應,鐵與水蒸汽反應,碳與水蒸氣反應等;
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com