
[探究一]實驗方案:鋁鎂合金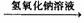 測定剩余固體質量
測定剩余固體質量
問題討論:
(1)稱取一定質量的鋁鎂合金粉末樣品,加入過量的NaOH溶液,充分反應。實驗中發生反應的離子方程式是______________。
(2)過濾、洗滌、干燥、稱量剩余固體。若未洗滌固體,測得鎂的質量分數將____ __(填“偏高”或“偏低”)。
 29.(12分)鋁鎂合金已成為輪船制造、化工生產等行業的重要材料。研究性學習小組的三位同學,為測定某鋁鎂合金(設不含其它元素)中鎂的質量分數,設計下列三種不同實驗方案進行探究。填寫下列空白。
29.(12分)鋁鎂合金已成為輪船制造、化工生產等行業的重要材料。研究性學習小組的三位同學,為測定某鋁鎂合金(設不含其它元素)中鎂的質量分數,設計下列三種不同實驗方案進行探究。填寫下列空白。
(5)甲、乙兩裝置均可用作實驗室由C制取B的裝置,乙圖采用甘油浴加熱(甘油沸點
(6)現有A和苯酚的混合物,它們的物質的量之和為 n mol。該混合物完全燃燒生成a L CO2和b g H2O(氣體體積為標準狀況下的體積)。設混合物中A的物質的量為x mol,列出x 的計算式 。
 A與C反應的化學方程式 。
A與C反應的化學方程式 。
(4)如A可以發生如圖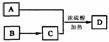 所示轉化關系 ,D的分子式為C10H12O3
,
所示轉化關系 ,D的分子式為C10H12O3
,
28.(17分)碳、氫、氧3種元素組成的有機物A,相對分子質量為152,其分子中C、H原子個數比為1:1,含氧元素的質量分數為31.58%。A遇FeCl3溶液顯紫色,其苯環上的一氯取代物有兩種,請回答下列問題:
(1)A的分子式是 。
(2)若A能與NaHCO3溶液反應, A的結構簡式為 ;寫出A 與
NaHCO3溶液反應的化學方程式 。
(3)寫出符合下列要求的A的同分異構體的結構簡式(只寫出兩種即可)
①與A的取代基數目相同;②可以和濃溴水發生取代反應,1mol該同分異構體可與2mol Br2發生取代反應;③屬于酯類物質。 、 。
將0.2mol?L−1的X溶液與0.1mol?L−1的Y溶液等體積混合后,溶液呈堿性。請判斷:
①X的化學式為 ,Y的化學式為
②混合溶液中各種帶電微粒的物質的量濃度由大到小的順序為
。
27. (16分)短周期中的A、B、C、D、E 5種元素,原子序數依次增大,A、D同主族;A、B的原子序數之和等于C的原子序數;C2−離子與D+離子的核外電子數相等;B原子與D+離子的核外電子數之和等于E原子的核外電子數,且D、E兩元素能形成微粒個數比為1┱1的離子化合物。
(1)B元素對應的單質的電子式為________D元素的離子結構示意圖為________
(2)A與B元素、A與C元素、均可構成18e-的分子,其化學式分別為______、______
(3)A、C元素可組成原子個數比為1┱1的共價化合物乙,將E單質通入乙的水溶液中,生成一種強酸,并有氣體放出,反應的化學方程式為
。
(4)A、B、C、D、E中的任意三種元素可組成多種化合物,X和Y是其中的兩種。X和Y都是既含離子鍵又含共價鍵的離子化合物;將X、Y分別溶于水時,X能促進水的電離,而Y能抑制水的電離,X水溶液的pH<7,Y水溶液的pH>7。
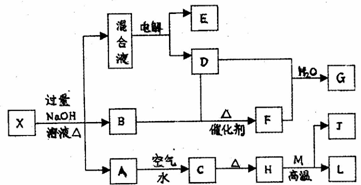
⑴B分子的空間構型為 ;B氣體的檢驗方法為 。
⑵電解混合液時陽極反應式為 。
⑶按要求寫出上述轉化關系中有關反應的化學方程式:
①含有L元素的化合反應: 。
②含有L元素的置換反應: 。
⑷L與過量G的稀溶液反應的離子方程式為: 。
⑸物質X的化學式為 。
⑹已知a g E氣體在D中完全燃燒生成穩定的化合物時,放出b KJ的熱量,寫出E燃燒熱的熱化學方程式: 。
26.(15分)有一化合物X(不含結晶水),其水溶液為淺綠色,可發生如下的轉化關系(部分反應物、生成物從略)。其中B、D、E、F均為無色氣體,M、L為常見的金屬單質,C為難溶于水的紅褐色固體。在混合液中加入BaCl2溶液可生成不溶于稀鹽酸的白色沉淀,H和M反應可放出大量的熱。請回答下列問題:
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com