
9.(2008揚州四調)某些鹽在溶液中結晶時,析出的晶體是結晶水合物。下表記錄了t℃的4份相同的硫酸銅溶液中加入的無水硫酸銅的質量以及析出的硫酸銅晶體(CuSO4·5H2O)的質量(溫度維持不變)的實驗數據:
|
硫酸銅溶液 |
① |
② |
③ |
④ |
|
加入的無水硫酸銅(g) |
2.50 |
5.00 |
8.00 |
11.0 |
|
析出的硫酸銅晶體(g) |
0.10 |
4.60 |
10.0 |
15.4 |
當加入a g(5<a<11)無水硫酸銅時,析出硫酸銅晶體的質量(g)為
A.1.8a-4.4 B.1.8a-8 C.1.8a-4.6 D.1.8a-0.1
[解析]根據圖中數據可知,原溶液不飽和,當溶液達飽和后,相比①所增加的固體量與多析出的晶體質量成正比,當加入5.00g時,相當于比①多加2.50g,此時多析出4.50g,當加入ag時,相當于比①多加入(a-2.50)g,所以設多析出質量X,即根據 可得X=(1.8a-4.5)g,再加上①析出的0.1g,所以選 A.
可得X=(1.8a-4.5)g,再加上①析出的0.1g,所以選 A.
[答案]A
[考點分析]本題考查溶解度的相關計算。
8.(上海盧灣區2008屆第一學期高三年級期末考試)常溫下,在密閉容器里分別充入兩種氣體各0.1 mol,在一定條件下充分反應后,恢復到原溫度時,壓強降低為開始時的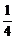 。則原混合氣體可能是。
。則原混合氣體可能是。
A.H2和O2 B.HCl和NH3
C.H2和Cl2 D.CO和O2
[解析]A中,根據2H2+O2=2H2O,剩余氣體0.05moL的氧氣;B中NH3+HCl=NH4Cl,剩余氣體為零;C中,H2+Cl2=2HCl
,氣體物質的量為0.2mol;D中,2CO+O2=2CO2,
剩余氧氣0.05mol,生成0.1moL的二氧化碳,總氣體是0.15mol。根據同溫同體積氣體,壓強比等于物質的量比,A壓強降低為開始時的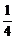 。
。
[答案]A
[考點分析]本題考查阿伏伽德羅定律的推論21世紀教育網
7.(江蘇省口岸中學2009屆高三年級第二次月考化學試題)25℃時,某硫酸銅溶液的質量分數為w,物質的量濃度為cmol/L,密度為ρg/mL,將此溶液蒸去a g水或再向原溶液中加入b g無水硫酸銅粉末,充分靜置并恢復至25℃時,均恰好全部轉化為CuSO4·5H2O晶體。則下列關系式正確的是
A.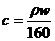 B.
B.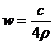 C.
C.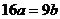 D.
D.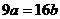
[解析]若100g溶液,溶液體積為100g/ρg.ml-1=1/10ρL,溶質的物質的量為100ω/160moL,則C=(100ω/160)moL÷(1/10ρ)L=1000ρω/160 ,AB錯;
設溶液質量為x,當蒸發ag水后獲得晶體,則[x(1-ω)-a]/Xω=90/160,當加入bg無水硫酸銅時獲得晶體,則x(1-ω)/( Xω+b)= 90/160,聯立兩式得16a=9b,C正確,D錯誤.
[答案]C
[考點分析]本題考查溶液溶解度的計算,通過溶解度將幾個常見物理量聯系起來。
6.(2008-2009學年度啟東市匯龍中學第一次月考)阿伏加德羅常數約為6.02×1023mol-1,下列敘述中正確的是
⑴0.25molNa2O2中含有的陰離子數為0.5×6.02×1023
⑵7.5gSiO2晶體中含有的硅氧鍵數為0.5×6.02×1023
⑶2.24LCH4中含有的原子數為0.5×6.02×1023
⑷250mL2mol/L的氨水中含有NH3·H2O的分子數為0.5×6.02×1023
⑸1L 1mol·L―1的HAc溶液中含有6.02×1023個氫離子
⑹18g D2O(重水)完全電解,轉移6.02×1023個電子
⑺22.4L SO2氣體,所含氧原子數為2×6.02×1023
⑻14g乙烯和丙烯的混合物中,含有共用電子對數目為3×6.02×1023
A.2個 B.3個 C.5個 D.6個
[解析]⑴錯,因為0.25molNa2O2中含有的陰離子0.25moL; ⑵正確,n(SiO2)=7.5/60
mol=0.125mol,每摩爾SiO2含有共價鍵是(1×4+2×2)/2 moL=4mol, 7.5gSiO2晶體中含有的硅氧鍵數為0.125×4×6.02×1023=0.5×6.02×1023
; ⑶錯,不知道氣體的存在的條件,無法計算;⑷錯,因為氨水中存在這如下平衡NH3 + H2O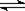 NH3·H2O
NH3·H2O 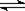 NH4++
NH4++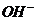 ; ⑸錯,因為Hac是弱電解質。⑹錯,18g D2O的物質的量小于1mol,⑺錯,因為不知道氣體的存在條件;⑻正確,因為乙烯與丙烯的最簡式都是CH2,1.4g乙烯與丙烯的混合物中相當于含有0.1molCH2。
; ⑸錯,因為Hac是弱電解質。⑹錯,18g D2O的物質的量小于1mol,⑺錯,因為不知道氣體的存在條件;⑻正確,因為乙烯與丙烯的最簡式都是CH2,1.4g乙烯與丙烯的混合物中相當于含有0.1molCH2。
[答案]A
[考點分析]以阿伏伽德羅常數的計算為背景考查:學生對物質組成的認識、晶體中共價鍵的數目、氣體摩爾體積的應用、溶液中微粒數、轉移的電子數、混合氣體中共用電子對的數目21世紀教育網
5. (2008鎮江期初)在標準狀況下①6.72L CH4 ②3.01×1023個HCl分子 ③13.6g H2S ④0.2mol NH3, 下列對這四種氣體的關系從大到小表達正確的是 ( )
a.體積②>③>①>④ b.密度②>③>④>①
c.質量②>③>①>④ d.氫原子個數①>③>④>②
A.abc B.bcd C.acd D.abcd
[解析]比較a、c、d時先將不同的物理量轉化為物質的量再進行比較,密度直接根據同溫同壓下,密度之比等于氣體的式量之比,直接根據式量判斷即可。
[答案]D
[考點分析]本題以物質的量為載體,考查物質的量與其他幾個物理量之間的關系,同時考查學生對阿伏伽德羅定律及其推論的應用能力21世紀教育網
4.(2009浙江卷8).用NA表示阿伏加德羅常數的值,下列說法正確的是
A.標準狀況下,5.6 L NO和5.6 L O2混合后的分子總數為0.5 NA
B.1 mol乙烷分子含有8 NA個共價鍵
C.58.5 g氯化鈉固體中含有NA個氯化鈉分子
D.在1 L 0.1 mol/L碳酸鈉溶液中陰離總數大于0.1 NA
[解析]考察阿伏加德羅常數。A中NO和O2會反應生成NO2;B中乙烷共價鍵有7NA;
C中氯化鈉含2NA個離子;D中碳酸鈉因水解而使陰離子增加。
[答案]D
[考點分析]以阿伏伽德羅常數的計算為背景考查:氣體摩爾體積的應用、物質中的共價鍵數、判斷晶體類型以及水解反應對溶液中微粒數的影響。
3.(2009全國Ⅰ卷7)將15 mL 2 mol·L-1 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L-1 MCln鹽溶液中,恰好將溶液中的Mn+離子完全沉淀為碳酸鹽,則MCln中n值是
A.4 B.3 C.2 D.1
[解析]M的化合價為+n,Na2CO3與MCln反應對應的關系式為:2Mn+ ~ nCO32 -
2 n
15×10-3×2 40×10-3×0.5
可得n=3,故選B。
[答案]B
[考點分析]本題以溶液中的離子反應為背景,考查學生物質的量應用于化學方程式的能力。
2.(2009廣東卷6)設nA 代表阿伏加德羅常數(NA )的數值,下列說法正確的是
A. 1 mol 硫酸鉀中陰離子所帶電荷數為nA
B. 乙烯和環丙烷(C3H6 )組成的28g混合氣體中含有3nA 個氫原子
C. 標準狀況下,22.4L氯氣與足量氫氧化鈉溶液反應轉移的電子數為nA
D.將0.1mol氯化鐵溶于1L水中,所得溶液含有0.1nA Fe3+
[解析]K2SO4中陰離子為硫酸根,1mol硫酸根所帶電荷為2mol,A錯誤。乙烯和C3H6的最簡式相同均為CH2,28g混合氣有2molCH2,所以含4molH原子,B錯誤。Fe3+在溶液中發生水解,0.1molFeCl3溶液中,Fe3+的物質的量要小于0.1mol,D錯誤21世紀教育網
[答案]C
[考點分析]以阿伏伽德羅常數的計算為背景考查:溶液中的電荷、混合物中原子數、氣體摩爾體積的應用以及水解反應對溶液中微粒數的影響。
該部分知識點主要體現在阿伏伽德羅常數的計算上,也涉及阿伏伽德羅定律及其推論。其他如一定物質的量濃度的計算、物質的量應用于化學方程式的計算往往穿插于大題之中,復習時要引起重視。
[典例精析]
1.(2009江蘇高考化學)用NA表示阿伏伽德羅常數的值。下列敘述正確的是:
A.25℃時,pH=13的1.0LBa(OH)2溶液中含有的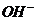 數目為0.2NA
數目為0.2NA
B.標準狀況下,2.24LCl2與過量的稀NaOH 溶液反應,轉移電子總數為0.2NA
C.室溫下,21.0g乙烯和丁烯的混合氣體中含有的碳原子數目為1.5NA
D.標準狀況下,22.4L甲醇中含有的氧原子數為1.0NA
[解析]pH=13,則c(OH-)=0.1mol·L-1,n(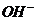 )=0.1mol,則N(OH-)=0.1NA,A錯誤;Cl2與NaOH 反應時,每摩Cl2轉移1mol電子,所以2.24LCl2應轉移0.1mol,B錯誤;
)=0.1mol,則N(OH-)=0.1NA,A錯誤;Cl2與NaOH 反應時,每摩Cl2轉移1mol電子,所以2.24LCl2應轉移0.1mol,B錯誤;
標況下,22.4L甲醇的物質的量遠大于1mol,所以D錯誤;
[答案]C21世紀教育網
[考點分析]以阿伏伽德羅常數的計算為背景考查:溶液中微粒數、氧化還原反應中轉移的電子數、混合物中原子數、以及氣體摩爾體積的應用21世紀教育網
關于阿伏加德羅常數的高考試題,常常有意設置一些極易疏忽的干擾因素。在分析解答這類題目時,要特別注意下列細微的知識點:①狀態問題,如水在標準狀況時為液態或固態;SO3在標準狀況下為固態、常溫常壓下為液態,戊烷及碳原子數更多的烴,在標準狀況下為液態或固態。②特殊物質的摩爾質量,如D2O、T2O、18 O2 等。③某些物質分子中的原子個數,如Ne、O3、白磷等。④一些物質中的化學鍵數目,如SiO2、Si、CH4、P4、CO2等。⑤較復雜的化學反應中,轉移電子數的求算,如Na2O2+H2O,C12+NaOH、電解AgNO3溶液等。⑥要用到22.4 L/mol時,必須注意氣體是否處于標準狀況。⑦某些離子或原子團在水溶液中能發生水解反應,使其數目減少。⑧注意常見的一些可逆反應。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com