
7.(08年廣東化學·6)相同質量的下列物質分別與等濃度的NaOH溶液反應,至體系中均無固體物質,消耗堿量最多的是A
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
答案:A
解析:m(Al):m(NaOH)=27:40;
m(Al(OH)3):m(NaOH)=75:40;
m(AlCl3):m(NaOH)=33.375:40;
m(Al2O3):m(NaOH)=51:40;
所以相同質量的物質,消耗堿量最多的是Al。故選A。
6.(2007海南·12)有BaCl2和NaCl的混合溶液aL,將它均分成兩份。一份滴加稀硫酸,使Ba2+離子完全沉淀;另一份滴加AgNO3溶液,使Cl 離子完全沉淀。反應中消耗xmol H2SO4、ymol AgNO3。據此得知原混合溶液中的c(Na+)/ mol·L-1為( )
離子完全沉淀。反應中消耗xmol H2SO4、ymol AgNO3。據此得知原混合溶液中的c(Na+)/ mol·L-1為( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
答案:D
考點:本題考查了物質的量的相關計算。
解析:本題的解題關鍵是將溶液分成兩份,即每份體積為a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl )=n( AgNO3)=ymol,根據電荷守恒
)=n( AgNO3)=ymol,根據電荷守恒
2x[Ba2+]+[Na+]=[Cl ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl )。N( Na+)=y-2xmol,所以c[Na+]為(y-2x)/2a 即(2y-4x)/a
。
)。N( Na+)=y-2xmol,所以c[Na+]為(y-2x)/2a 即(2y-4x)/a
。
5.(2007海南·4)下列敘述正確的是( )
A.一定溫度、壓強下,氣體體積由其分子的大小決定
B.一定溫度、壓強下,氣體體積由其物質的量的多少決定
C.氣體摩爾體積是指1mol任何氣體所占的體積為22.4L
D.不同的氣體,若體積不等,則它們所含的分子數一定不等
答案:B
考點:本題考查了阿伏加德羅定律及其應用。
解析:由PV=nRT可知:氣體的體積在溫度、壓強一定時,體積與物質的量成正比;當分子數目相同時,氣體體積的大小主要決定于氣體分子之間的距離,而不是分子本身體積的大小。 所以A、D錯;B正確;只有標況下氣體摩爾體積才近似為22.4L/mol。
4.(07年廣東理基·22)已知阿伏加德羅常數為NA,下列說法正確的是
A.2 mol重水含有NA個D2O分子
B.1 g氫氣含有NA個H2分子
C.2 mol鈉與過量稀鹽酸反應生成NA個H2分子
D.22.4 L水含有NA個H2O分子
答案:C
解析:2 mol重水含有2NA個D2O分子,故A選項錯誤;1 g氫氣的物質的量為mol,因此含有有NA個H2分子,B選項錯誤;2 mol鈉在反應中失去2mol電子,因此在反應中得到1mol,故C選項正確;水為液態,22.4 L水也不是1mol,故D選項錯誤。
3.(07年廣東化學·3)下列敘述正確的是
A.48gO3氣體含有6.02×1023個O3分子
B.常溫常壓下,4.6gNO2氣體含有1.81×1023個NO2分子
C.0.5mol·L-1CuCl2溶液中含有3.01×1023個Cu2+
D.標準狀況下,33.6LH2O含有9.03×1023個H2O分子
答案:A
解析:解題時要注意回憶概念、分析原理注意運算公式的適用范圍。B選項4.6gNO2氣體中理論上含有1mol NO2分子,約6.02×1023個NO2分子,由于2NO2
 N2O4,故應小于6.02×1023個,具體多少無法計算。C選項中要考慮Cu2+的水解,也無法確定其數目,D選項標準狀況下H2O冰水混合物,不能用標準狀況下氣體摩爾體積22.4L/ mol來計算。
N2O4,故應小于6.02×1023個,具體多少無法計算。C選項中要考慮Cu2+的水解,也無法確定其數目,D選項標準狀況下H2O冰水混合物,不能用標準狀況下氣體摩爾體積22.4L/ mol來計算。
2.(07年寧夏理綜·12) a g鐵粉與含有H2SO4的CuSO4溶液完全反應后,得到a g銅,則參與反應的CuSO4與H2SO4的物質的量之比為
A.1 :7 B.7 :1 C.7 :8 D.8 :7
答案:B
解析:根據題意可以知道,鐵粉完全反應且反應前后固體的質量不變,因此設參加反應的CuSO4與H2SO4的物質的量分別為x和y,則:
Fe + CuSO4 = FeSO4+Cu △m
1mol 56g
x 56 x g·mol-1
Fe + H2SO4 = FeSO4+H2↑ △m
1mol 8g
y 8 y g·mol-1
因反應前后固體的質量沒有發生變化,因此第一個反應質量的減小等于第二個反應質量的增加,即56x
g·mol-1=8 y
g·mol-1,所以 。
。
1.(07年寧夏理綜·10)若NA表示阿佛加德羅常數,下列說法正確的是
A.1 mol Cl2作為氧化劑得到的電子數為NA
B.在0℃,101kPa時,22.4L氫氣中含有NA個氫原子
C.14g氮氣中含有7NA個電子
D.NA個一氧化碳分子和0.5 mol 甲烷的質量比為7︰4
答案:C
解析:Cl2作為氧化劑時化合價有0價降低為-1價,而Cl2是雙原子分子,因此1 mol Cl2作為氧化劑得到的電子數應為2NA,故A選項錯誤;在標準狀況(0℃、101kPa)時,22.4L氫氣的物質的量的1mol,其中含有的H原子的物質的量為2mol,即含有2NA個氫原子,故B選項錯誤;14g氮氣中含有的電子的物質的量為 =7mol,即電子數為7NA個,所以C選項正確;NA個一氧化碳分子的物質的量為1mol,其質量為28g,0.5 mol 甲烷的質量為0.5
mol × 16 g·mol-1=8g,所以而的質量比為28g︰8g=7︰2,因此D選項錯誤。
=7mol,即電子數為7NA個,所以C選項正確;NA個一氧化碳分子的物質的量為1mol,其質量為28g,0.5 mol 甲烷的質量為0.5
mol × 16 g·mol-1=8g,所以而的質量比為28g︰8g=7︰2,因此D選項錯誤。
28.(16分)菠菜營養豐富,素有“蔬菜之王”的美稱。民間流傳:菠菜豆腐同食,易得結
石。某化學興趣小組對“菠菜豆腐是否不能同食”等問題進行了探究。
[查閱資料]①菠菜含有豐富的鐵、草酸鹽、碳酸鹽等,豆腐中含有豐富的蛋白質及鈣鹽。
②人體結石的主要成分:草酸鈣(CaC2O4)
③醋酸不與草酸鈣反應,但能與碳酸鈣反應生成可溶性鹽等。
[提出猜想]“菠菜豆腐不能同食”的原因可能是 ▲ 。
 [探究一]菠菜中部分成分分析
[探究一]菠菜中部分成分分析
(1)步驟③中加入足量的CaCl2溶液的目的 ▲ 。
(2)已知氣體C能使澄清石灰水變渾濁,醋酸的化學式用HAC表示,寫出步驟④的化學反
應方程式 ▲ 。沉淀A、B的質量關系為:m(A) ▲ m(B)(填“>”、“<”
或“=”)。
(3)白色沉淀B的化學式為 ▲ ,由此可見菠菜豆腐不能同食。以下飲食觀點正確的是
▲ (填字母)
A.禁吃菠菜 B.高鈣牛奶可與菠菜同食
C.菠菜烹飪時可用開水燙,可降低草酸鹽含量
[探究二]某草酸鈣晶體(CaC2O4·xH2O)熱分解研究
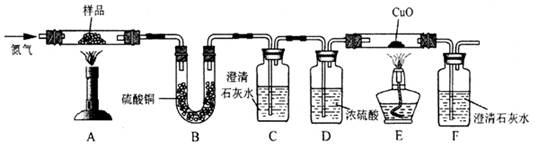 按下圖裝置將草酸鈣晶體樣品高溫加熱,使其完全分解,對所得氣體產物進行探究(假設裝置中各試劑均足量)
按下圖裝置將草酸鈣晶體樣品高溫加熱,使其完全分解,對所得氣體產物進行探究(假設裝置中各試劑均足量)
(4)①反應開始前通入氮氣的目的是 ▲ 。
②裝置B中硫酸銅粉末變藍,說明產物中有 ▲ ,C、F中澄清石灰水均變渾濁,E
中CuO變紅,說明產物還有 ▲ 和 ▲ ,經檢驗A中殘留固體為氧化物。
③對上述裝置從環保角度提一個改進建議 ▲ 。
(5)某研究所利用SDT Q600熱分析儀對草酸鈣晶體(CaC2O4·xH2O)進行熱分解,獲得
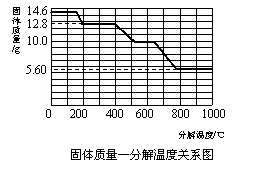 相關數據,繪制成固體質量-分解溫度的關系如右圖。
相關數據,繪制成固體質量-分解溫度的關系如右圖。
①800℃以上時,固體成分的化學式為 ▲ 。
②計算CaC2O4·xH2O中的x(寫出計算過程,
CaC2O4的相對分子質量:128)。
③殘留固體為CaC2O4時的溫度范圍 ▲ ,
寫出固體質量由12.8g變為10.0g時的化學
方程式 ▲ 。
27. (8分)某研究性學習小組對雙氧水開展如下研究。
(8分)某研究性學習小組對雙氧水開展如下研究。
(1)圖1中儀器①的名稱 ▲ ,該裝置中發
生的化學方程式為 ▲ 。圖1裝置也可
以用于實驗室制 ▲ 氣體(只填一種即
可)
(2)小楊同學將MnO2與水泥按一定比例加水
混合、凝固,制作成小塊狀固體,加入圖
2裝置中制氧氣,以方便實驗結束回收二氧化錳。實驗前檢查該裝置氣密性的方法是:
打開旋塞,從長頸漏斗口注水至 ▲ ,關閉旋塞,繼續注水,使漏斗中液面略高于試
管中液面,一段時間后,高度差不變,說明氣密性良好。其中塊狀固體應放置在 ▲ 處
(填“A”或“B”)
(3)利用圖2裝置反應一段時間后,需停止反應,其操作是 ▲ 。
(4)Cu與稀硫酸不能直接反應,但滴加H2O2溶液并加熱,能生成水和一種藍色溶液。則
該反應的化學方程式為 ▲ 。
26.(8分)下圖是氧化沉淀法生產復印用高檔Fe3O4粉的工藝流程簡圖,根據要求回答問題。
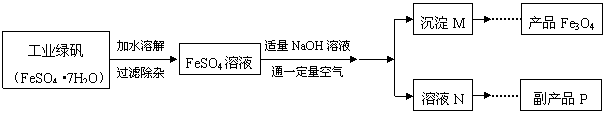
(1)鐵的另兩種常見氧化物的化學式是 ▲ 、 ▲ 。
(2)加水溶解過程中,在實驗室里通常要使用的玻璃儀器有燒杯和 ▲ ,操作A的名稱
是 ▲ 。
(3 )副產品P是 ▲ ,由溶液N獲得該副產品的操作順序是b→ ▲ → ▲ →d。
a.過濾 b.加熱濃縮 c.冷卻結晶 d.晶體加熱至完全失去結晶水
|
Fe3O4的過程中發生的反應為Fe(OH)2 + 2Fe(OH)3 === Fe3O4 + 4H2O,控制“一
定量空氣 ”的目的是 ▲ ,沉淀M中Fe(OH)2 和Fe(OH)3的最佳質量比為 ▲ 。
(相對分子質量:Fe(OH)2 -90,Fe(OH)3-107)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com