
例3. 如圖3所示,細繩繞過兩個定滑輪A和B,在兩端各掛一個重為P的物體,現(xiàn)在A、B的中點C處掛一個重為Q的小球,Q<2P,求小球可能下降的最大距離h。已知AB的長為2L,不計滑輪和繩之間的摩擦力及繩的質(zhì)量。
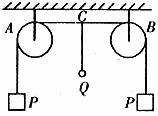
圖3
解析:選小球Q和兩重物P構成的整體為研究對象,該整體的速率從零開始逐漸增為最大,緊接著從最大又逐漸減小為零(此時小球下降的距離最大為h),如圖4在整個過程中,只有重力做功機械能守恒。
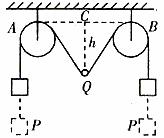
圖4
因重為Q的小球可能下降的最大距離為h,所以重為P的兩物體分別上升的最大距離均為 。
。
考慮到整體初、末位置的速率均為零,故根據(jù)機械能守恒定律知,重為Q的小球重力勢能的減少量等于重為P的兩個物體重力勢能的增加量,即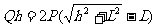 。
。
從而解得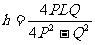
[模型要點]
“滑輪”模型的特點為滑輪兩側的受力大小相等,在處理功能問題時若力發(fā)生變化,通常優(yōu)先考慮能量守恒規(guī)律,也可采用轉(zhuǎn)化法求解。
[誤區(qū)點撥]
注意“死桿”和“活桿”問題。
如:(2006年無錫統(tǒng)考)如圖(a)輕繩AD跨過固定在水平橫梁BC右端的定滑輪掛住一個質(zhì)量為M1的物體。∠ACB=30°;圖(b)中輕桿HG一端用鉸鏈固定在豎直墻上,另一端G通過細繩EG拉住,EG與水平方向也成30°,輕桿的G點用細繩GF拉住一個質(zhì)量為M2的物體,求細繩AC段的張力FTAC與細繩EG的張力FTEG之比?
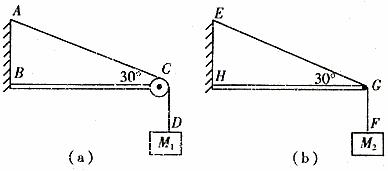
圖5
解析:圖(a)中繩AC段的拉力FTAC=M1g
圖(b)中由于FTEGsin30°=M2g,解得:
[模型演練]
1. 在圖6所示的裝置中,繩子與滑輪的質(zhì)量不計,摩擦不計,懸點a與b之間的距離遠大于兩輪的直徑,兩個物體的質(zhì)量分別為m1和m2,若裝置處于靜止狀態(tài),則下列說法錯誤的是( )
A.  可以大于
可以大于
B. 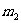 必定大于
必定大于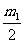
C. 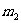 必定等于
必定等于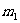
D.  與
與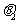 必定相等
必定相等
答案:C
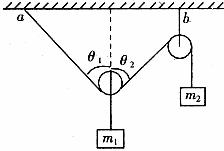
圖6
例2. 如圖2所示在車廂中有一條光滑的帶子(質(zhì)量不計),帶子中放上一個圓柱體,車子靜止時帶子兩邊的夾角∠ACB=90°,若車廂以加速度a=7.5m/s2向左作勻加速運動,則帶子的兩邊與車廂頂面夾角分別為多少?
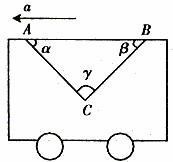
圖2
解析:設車靜止時AC長為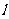 ,當小車以
,當小車以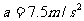 向左作勻加速運動時,由于AC、BC之間的類似于“滑輪”,故受到的拉力相等,設為FT,圓柱體所受到的合力為ma,在向左作勻加速,運動中AC長為
向左作勻加速運動時,由于AC、BC之間的類似于“滑輪”,故受到的拉力相等,設為FT,圓柱體所受到的合力為ma,在向左作勻加速,運動中AC長為 ,BC長為
,BC長為
由幾何關系得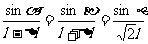
由牛頓運動定律建立方程:

代入數(shù)據(jù)求得
說明:本題受力分析并不難,但是用數(shù)學工具解決物理問題的能力要求較高。
例1. (2005年煙臺市檢測題)如圖1所示,將一根不可伸長、柔軟的輕繩左、右兩端分別系于A、B兩點上,一物體用動滑輪懸掛在輕繩上,達到平衡時,兩段繩子間的夾角為 ,繩子張力為
,繩子張力為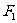 ;將繩子右端移到C點,待系統(tǒng)達到平衡時,兩段繩子間的夾角為
;將繩子右端移到C點,待系統(tǒng)達到平衡時,兩段繩子間的夾角為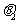 ,繩子張力為
,繩子張力為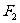 ;將繩子右端再由C點移到D點,待系統(tǒng)達到平衡時,兩段繩子間的夾角為
;將繩子右端再由C點移到D點,待系統(tǒng)達到平衡時,兩段繩子間的夾角為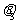 ,繩子張力為
,繩子張力為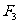 ,不計摩擦,并且BC為豎直線,則( )
,不計摩擦,并且BC為豎直線,則( )
A. 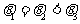 B.
B.
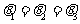
C. 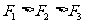 D.
D.

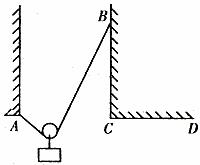
圖1
解析:由于跨過滑輪上繩上各點的張力相同,而它們的合力與重力為一對平衡力,所以從B點移到C點的過程中,通過滑輪的移動,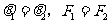 ,再從C點移到D點,
,再從C點移到D點,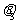 肯定大于
肯定大于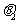 ,由于豎直方向上必須有
,由于豎直方向上必須有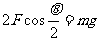 ,所以
,所以 。故只有A選項正確。
。故只有A選項正確。
(五)物質(zhì)的量(n)、氣體的體積(V)和氣體摩爾體積(Vm)在一定狀況下三者關系式:n=V/Vm。
[思考感悟]
1、描述氣體體積時,為什么要限定條件?
氣體體積除與氣體分子數(shù)的多少有關外,還與外界溫度、壓強有關,只有在限定條件下,才能對其體積和物質(zhì)的量進行計算。
2、1mol氣體只有在標準狀況時才是22.4L嗎?
不一定。因為氣體體積受溫度和壓強的影響。在標準狀況時,1mol任何氣體的體積都約為22.4L,在升高溫度,增大壓強或減小壓強,降低溫度時,1mol氣體的體積也可能是22.4L。
[基礎訓練]
1、下列說法正確的是( D )
①標準狀況下,22.4L己烯含有的分子數(shù)約為6.02×1023;
②標準狀況下,a L的氧氣和氮氣的混合物含有的分子數(shù)約為a×6.02×1023/22.4;
③7.1g氯氣與足量的氫氧化鈉溶液反應轉(zhuǎn)移的電子數(shù)約為0.2×6.02×1023;
④10g重水中含有的中子數(shù)約為4×6.02×1023;
⑤1mol乙醇中含有的共價鍵數(shù)約為7×6.02×1023;
⑥500mL1mol·L-1的硫酸鋁溶液中含有的硫酸根離子數(shù)約為1.5×6.02×1023。
A、①④ B、②⑤ C、③⑤ D、②⑥
2、在25℃、100kPa條件下,將15LO2通入10LCO和H2的混合氣體中,使其完全燃燒,干燥后,恢復至原來的溫度和壓強。
(1)若剩余氣體的體積是15L,則原CO和H2的混合氣體中:V(CO)=5L,V(H2)=5L。
(2)若剩余氣體的體積為a L,則原CO和H2的混合氣體中V(CO)︰V(H2)=(a-10)/(20-a),a的取值范圍是10<a<20。
(2H2+O2=2H2O(l),2CO+O2=2CO2(g)。10L混合氣體完全燃燒只需要5LO2,故15LO2過量。反應后O2剩余10L。(1)若剩余氣體15L,其中有10LO2和5LCO2,故V(CO)=5L,V(H2)=(10-5)L=5L;(2)若剩余氣體為aL,其中有10LO2和(a-10)LCO2,則V(CO)=(a-10)L,V(H2)=10L-(a-10)L=(20-a)L,V(CO)/V(H2)=(a-10)/(20-a)。a的取值范圍可采用極限假設法求得:若10L氣體全部為H2,則反應后剩余10LO2;若10L氣體全部為CO,則反應后得到10LCO2和剩余的10LO2。因此a的取值范圍為10<a<20)
3、a g銅與一定量的濃HNO3完全反應,生成標準狀況下NO2、NO共11.2L,則:
(1)反應中消耗的硝酸為a/32+0.5mol(用a的代數(shù)式表示,下同)。
(2)若在11.2LNO2、NO混合氣中,至少通入標準狀況0.175a LO2使氮的氧化物完全溶解于水。
(本題主要考查原子、電子守恒的計算。(1)依據(jù)N原子守恒,則被還原的HNO3的物質(zhì)的量為11.2L/22.4L·mol-1=0.5mol,酸性作用的硝酸的物質(zhì)的量為2ag/64g·mol-1=a/32mol,則n(HNO3)消耗=(a/32+0.5)mol。(2)由銅與濃HNO3反應,生成的NO2、NO又與O2反應完全溶于水,轉(zhuǎn)化為硝酸,此過程可看作銅失去的電子全部轉(zhuǎn)給O2,即由電子得失守恒得:2Cu-O2,則標準狀況下,V(O2)=ag/64g·mol-1×1/2×22.4L·mol-1=0.175aL。)
[高考模擬]
4、(2008海南化學3)在兩個密閉容器中,分別充有質(zhì)量相同的甲、乙兩種氣體,若兩容器的溫度和壓強均相同,且甲的密度大于乙的密度,則下列說法正確的是( B )
A、甲的分子數(shù)比乙的分子數(shù)多 B、甲的物質(zhì)的量比乙的物質(zhì)的量少
C、甲的摩爾體積比乙的摩爾體積小 D、甲的相對分子質(zhì)量比乙的相對分子質(zhì)量小
(同溫、同壓下,同質(zhì)量的甲比乙的密度大,說明甲的體積小于乙的體積,也就說明了甲的物質(zhì)的量小于乙的物質(zhì)的量,這是根據(jù)阿伏加德羅定律可得出)
5、(2008海南化學4)鋅與很稀的硝酸反應生成硝酸鋅、硝酸銨和水。當生成1mol硫酸鋅時,被還原的硝酸的物質(zhì)的量為( D )
A、2mol B、1mol C、0.5mol D、0.25mol
(根據(jù)電子守恒進行計算)
[作業(yè)]
(四)適用范圍:只適用于氣體,不適用于固體和液體。
(三)數(shù)值:在標準狀況下(指溫度為0℃(273K),壓強為1.01×105Pa)約等于22.4L。
(二)單位:L·mol-1或mL·mol-1。
(一)定義:一定溫度和壓強下,單位物質(zhì)的量的氣體所占的體積。
(三)聚集狀態(tài)體現(xiàn)物質(zhì)的物理性質(zhì)的不同。
(二)同一物質(zhì)在不同的溫度和壓強下,聚集狀態(tài)可能不同,不同的物質(zhì)在同一溫度及壓強下,聚集狀態(tài)也可能不同。
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com