
化學計算
考點聚焦
1、高考中化學計算主要包括以下類型:①有關相對原子質量、相對分子質量及確定分子式的計算;②有關物質的量的計算;③有關氣體摩爾體積的計算;④有關溶液濃度(質量分數和物質的量濃度);⑤利用化學方程式的計算;⑥有關物質溶解度的計算;⑦有關溶液pH值與氫離子濃度、氫氧根離子濃度的簡單計算;⑧有關燃燒熱的簡單計算;⑨以上各種化學計算的綜合應用。
2、常見題型為計算選擇題,計算填空題、實驗計算題、計算推斷題和綜合計算題,而計算推斷題和綜合計算題,力求拉開學生的層次。
3、近年高考化學計算題主要有以下特點:
(1)注意速算巧解
一般在第Ⅰ卷中會出現五到七個左右要計算的量很少或者根本不需要計算的試題。其命題意圖是考查對化學知識的理解、掌握和運用。重點考查學生運用題給信息和已學相關知識進行速算巧解的能力。
(2)起點高、落點低
這方面主要是第Ⅱ卷中的計算題。試題常以信息給予題的形式出現,但落點仍是考查基本計算技能。
(3)學科滲透,綜合考查
主要考查各種數學計算方法的運用、物理學科中的有效數字及語文學科的閱讀能力。
(4)綜合計算題的命題趨勢是理論聯系實際,如以生產、生活、環境保護等作為取材背景編制試題,考查視野開闊,考查學生用量的觀點把握化學知識、原理、過程等。
4、學生化學計算題失分的主要原因
 1、審題不夠仔細;
1、審題不夠仔細;
2、基礎不夠扎實;
3、思考不夠全面;
八個“不夠” 4、思維不夠靈敏;
5、運算不夠準確;
6、格式不夠規范;
7、表達不夠清楚;
8、時間不夠充裕。
化學計算是學生必須掌握的基本技能之一。而思維能力較差的學生就是害怕計算,其原因是:一、對計算所依托的基本化學原理和性質不熟悉;二、對基本的計算技能掌握不到位;三、思維不靈活,不會審題,不會尋找解題的突破口,不會分析問題,也就不會解決問題。要求教師加強解題策略相關知識的教學;加強學科問題解決的研究。
1. 將Wg鐵、氧化鐵和氧化銅組成的混合物粉未放入100mL 4.4mol/L鹽酸中,反應完全后得氫氣896mL(標況),生成的溶液中只有FeCl2、HCl和
分析:解答此題的關鍵,是審清題意,找出等量關系,選準突破口。首先確定由生成溶液中的鹽酸可知反應后的
解法一:
Cu的物質的量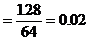 mol
mol
CuO的質量=0.02×80=1.6(g)
設混合物中Fe2O3的物質的量為x。
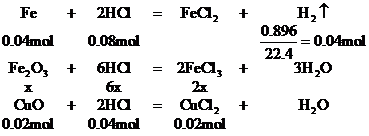
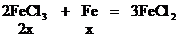
 CuCl2 +
Fe = FeCl2 +Cu
CuCl2 +
Fe = FeCl2 +Cu
0.02mol 0.02mol
根據反應耗用鹽酸的量列方程求解
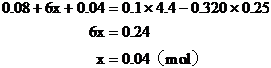
Fe2O3的質量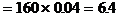 (g)
(g)
Fe的質量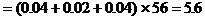 (g)
(g)
解法二:
設混合物中含鐵的物質的量為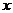 ,Fe2O3的物質的量為
,Fe2O3的物質的量為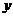
根據氧化還原反應中的電子守恒
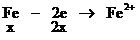
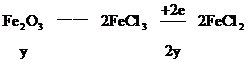
2H+――H2得電子的物質的量0.04×2(mol)
CuO――Cu得電子的物質的量0.02×2(mol)
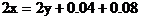
根據 守恒列方程
守恒列方程
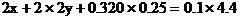
解方程組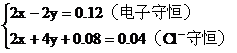

Fe的質量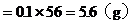
Fe2O3的質量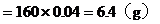
2. 某化工廠用NH3制備NH4NO3。已知NH3制NO的產率是96%;NO制HNO3的產率是92%,HNO3與NH3反應生成NH4NO3。則制HNO3所用去NH3的質量占總耗NH3的質量的百分比是多少?(不考慮生產上的其它損耗)
分析:根據反應
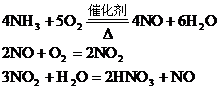
由于生產中NO2與H2O反應生成HNO3和NO,不斷地補充空氣使NO多次被氧化成NO2,被水吸收,最后比較完全轉化HNO3,因此,第三步反應在考慮到循環反應后可用下式表示:
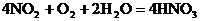
由以上四個反應可得最初反應物與最終產品的關系式:
4NH3~4NO~4NO2~4HNO3
設生產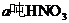 耗用NH3為x噸,生產NH4NO3耗用NH3 y噸
耗用NH3為x噸,生產NH4NO3耗用NH3 y噸
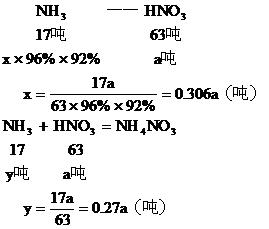
生產HNO3耗用NH3的質量百分比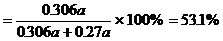
答:略。
3. 金屬錫的純度可以通過下述方法分析:將試樣溶于鹽酸,反應的化學方程式為:Sn+2HCl=SnCl2+H2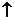 再加入過量的FeCl
再加入過量的FeCl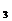 溶液,發生如下反應:SnCl2+2FeCl
溶液,發生如下反應:SnCl2+2FeCl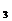 =SnCl4+2FeCl2最后用已知濃度的K2Cr2O7溶液滴定生成Fe2+,反應的化學方程式為:
=SnCl4+2FeCl2最后用已知濃度的K2Cr2O7溶液滴定生成Fe2+,反應的化學方程式為: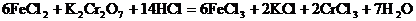 現有金屬錫試樣
現有金屬錫試樣
分析:該題是應用關系式法解多步反應的綜合計算。根據題目所給出的三個化學反應,得出Sn與K2Cr2O7的物質量的關系。
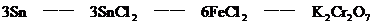
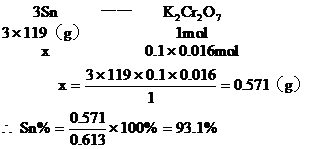
答:略。
鞏固聯系
4. 在100mL 36.5%的濃鹽酸(密度為
分析:任何溶液在稀釋時,溶液和溶劑的量都要發生變化,但溶質的量不變,據此可以得到稀釋下列各種濃度的溶液計算公式。
百分比濃度溶液的稀釋公式:
濃溶液的質量×濃溶液的濃度 = 稀溶液的質量×稀溶液的濃度
mol爾濃度的溶液稀釋公式:
濃溶液的濃度×濃溶液的體積(L) = 稀溶液的濃度×稀溶液的體積
同一溶質的兩種不同濃度的溶液混合時,混合溶液的濃度介于溶液之間,混合液跟兩原溶液中溶質、溶液量的基本關系是:
(1)混合液中所含溶質的總量等于兩原溶液的溶質質量之和。
(2)混合溶液的質量等于兩原溶液的質量之和,但體積不等于兩原溶液的體積之和(當兩原溶液很稀時,通常把混合液的體積近似地看做兩原溶液的體積之和。)
在應用上述關系進行復雜的混合溶液計算時,可先算出混合溶液的總質量和溶質的總質量,然后再求出混合溶液的濃度。
設需加入VmL 2mol/L的鹽酸
混合液中溶質的總物質的量
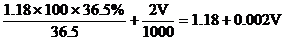
混合溶液的總體積:

混合液的物質的量濃度:
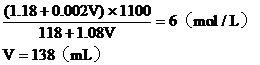
答:略
5. 氯氣通入氨水中發生下列反應: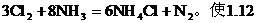 L氯、氮混合氣(90%Cl2、10%的N2)通入濃氨水實驗測得逸出氣體在標況下為
L氯、氮混合氣(90%Cl2、10%的N2)通入濃氨水實驗測得逸出氣體在標況下為
分析:設有xg氮氣被氧化
由方程式可得出:
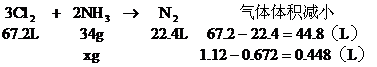
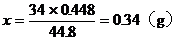
答:略。
6. 將5.000gNaCl、NaBr、CaCl2的混合物溶于水,通入氯氣充分反應,然后把溶液蒸干并灼燒,得殘留物
分析:根據題意可列出下圖示,幫助審清題意,找出思路和解法。
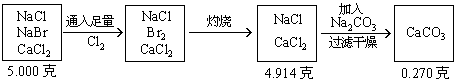
根據圖示可分析:
(1)CaCO3的質量為
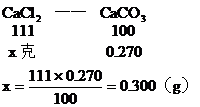
(2)混合物中通入Cl2
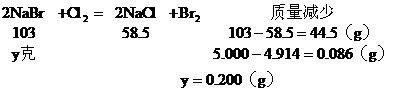
(3)NaCl的質量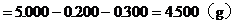
(4)各組分的百分含量
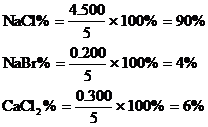
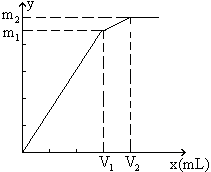
7.向含0.02mol Al3+的明礬溶液中,逐滴加入0.1mol/L的Ba(OH)2溶液時,產生沉淀的質量y(g)與Ba(OH)2溶液的體積x(mL)的關系如圖所示。求圖中:
V1=
V2=
m1=
m2=
分析:本題要從分析圖中所體現的產生沉淀的質量與加入Ba(OH)2體積的函數關系求出V1、V2和m1、m2的值。
從圖中可以看出,當加入V1mL的Ba(OH)2時,可得沉淀m
(1)含有0.02mol Al3+的明礬溶液中含有0.04mol的SO42-。
當加入V1mL Ba(OH)2時,
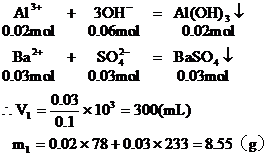
(2)當加入V2mL Ba(OH)2溶液時,
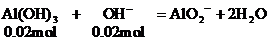
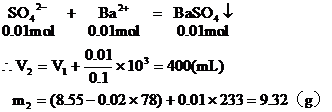
8.某金屬R
分析:設R的原子量為m,兩種金屬氯化物的分子式分別為RClx和RCly
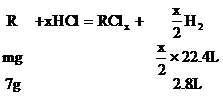
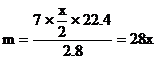 ………①
………①
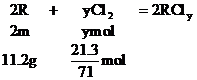
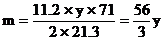 ………②
………②
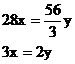
討論:(1)當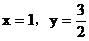 不合理
不合理
(2)當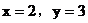 合理
合理
(3)當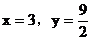 不合理
不合理
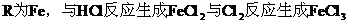
9. 混合兩種未知物的溶液,生成
分析:能使石灰水變渾濁且無刺激性氣味的氣體應是CO2,故
設碳酸鹽的分子式為MCO3
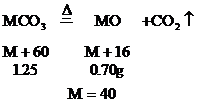
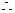 此二價金屬為Ca。
此二價金屬為Ca。
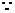 濾液蒸干后得
濾液蒸干后得
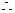 此氣態氧化物的mol爾質量為:
此氣態氧化物的mol爾質量為:
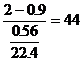 (g/mol)
(g/mol)
分解產物的mol爾比:
H2O∶RxOy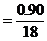 ∶
∶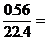 0.05∶0.025
0.05∶0.025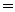 2∶1
2∶1
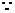 分解產物為H2O和氣態氧化物,分解溫度為
分解產物為H2O和氣態氧化物,分解溫度為
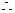 此鹽只能是NH4NO3
此鹽只能是NH4NO3
設其分解產物為H2O和NxOy
則對NxOy而言有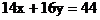
則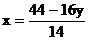
討論,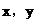 均為正整數,且只可能是1或2,
均為正整數,且只可能是1或2,
(1)若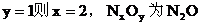
(2)若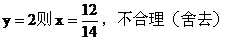
由此可肯定此鹽為NH4NO3,熱分解產物為H2O和N2O。
 未知物是
未知物是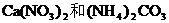
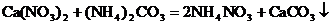
10. 兩種烴的混合氣體20mL,跟過量的氧氣混合點燃,當產物通過濃H2SO4時,體積減小30mL,通過堿石灰后的體積又減少40mL(以上均換算成標準狀況的體積),問該混合物的組成可能有幾種?在各種可能組成中,每種烴各是多少?
分析:氣態烴的碳原子數都小于4。20mL混合烴完全燃燒生成40mL CO2和30mL水蒸氣,可知1mol混合烴平均含2mol C原子和3mol H原子,從而推知,該混合烴只能是C2H6和C2H2或C2H4和C2H2的混合物。
討論:
(1)若混合烴含有x mL C3H6,則含有(20-x)mL C2H2
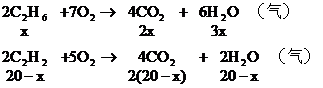
由題意可知:
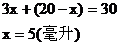
C2H2:20-5=15(mL)
(2)若混合烴含有y mL C2H4,則含有 ,
,
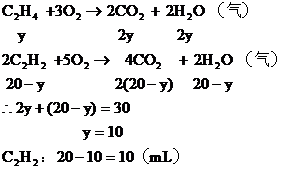
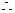 可能有兩種組合
可能有兩種組合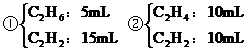
11. 現有氧化銅和碳粉的混合物共Amol,將它在隔絕空氣條件下加熱,反應完全后,冷卻,得到殘留固體。
(1)寫出可能發生反應的化學方程式
(2)若氧化銅在混合物中的量的比值為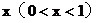
問:x為何值時,殘留固體為何種物質?寫出殘留固體的物質的量與x值之間 的關系。將結果填入下表。
殘 留 固 體
x值
分 子 式
物質的量
分析:(1)首先寫出有關的化學反應方程式,根據化學方程式中有關物質間的物質的量的關系,分析當CuO恰好完全反應時,x值是多少?
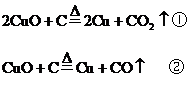
按①式反應,x值為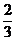 時,反應物恰好反應;按②式反應,x值為
時,反應物恰好反應;按②式反應,x值為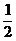 時,反應物恰好完全反應。
時,反應物恰好完全反應。
(2)當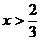 時,CuO過量,按C的量計算。
時,CuO過量,按C的量計算。
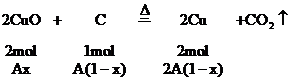
剩余CuO的物質的量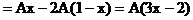
(3)當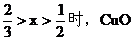 不足量,按CuO的量計算,生成銅的量為Ax。
不足量,按CuO的量計算,生成銅的量為Ax。
(4)當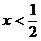 時,C過量,按②式中的CuO的量計算,生成銅為Ax,剩余C的物質的量為:
時,C過量,按②式中的CuO的量計算,生成銅為Ax,剩余C的物質的量為:
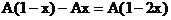
將所得結果的有關數值填入下表:
x 值
殘 留 固 體
分 子 式
物 質 的 量
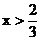
Cu
CuO
A(3x-2)
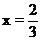
Cu
Ax(或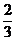 A)
A)
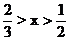
Cu
Ax
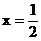
Cu
Ax(或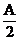 )
)
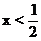
Cu
C
Ax
A(1-2x)
12.
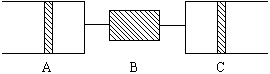
(1)C中發生的反應,其化學方程式是 。已知原C中的氣體為單一氣體,它是 。(若有多種可能答案,需一一列出。)將反應后C筒中的氣體,用水吸收后,氣體體積,減小一半,則與水反應前C中的氣體是 。(若有多種答案需一一列出。)
(2)若實驗開始前A、C中的氣體體積(換算成標況)分別為
分析:本題要求學生將分子量、物質的量、氣體摩爾體積、化學方程式計算與元素及其化合物的性質結合起來,根據試題給出的條件,進行分析、推理和論證。
(1)由C筒中發生的化學現象氣體由無色變為紅綜色,可判斷C中發生的化學反應為:2NO+O2=2NO2;又根據C筒中的氣體反應后并無體積變化,可知C中為NO,由B管進入C中氣體為純O2,反應后O2并未過量。與水反應后,氣體體積減半,已知與水反應前C筒中的氣體為NO2和NO的混合氣。
(2)設與水反應前C筒中NO2的體積為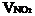 ,NO為
,NO為 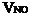 ,根據題意列方程組:
,根據題意列方程組:
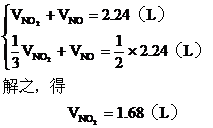
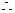 由B管進入C筒中的
由B管進入C筒中的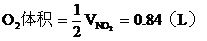
若
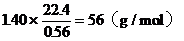
對照試題所給出的已知氣體中沒有一種氣體的mol爾質量等于或大于
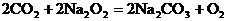
討論:(1)若A中的氣體全部是CO2(即進入C的O2全部由CO2和Na2O2反應而得。)根據反應方程式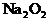 反應生成O2的體積為
反應生成O2的體積為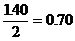 (L)這與進入C筒中O2的體積不符。(
(L)這與進入C筒中O2的體積不符。(
(2)若A中的氣體是CO2和O2的混合氣。設A中CO2和O2的體積分別為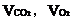 。
。
根據題意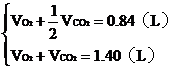
解題: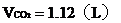
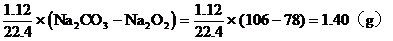
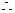 該結果與題設條件相符,所以A中的氣體是CO2和O2的混合氣體。
該結果與題設條件相符,所以A中的氣體是CO2和O2的混合氣體。
A中的氣體的質量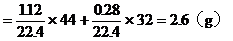 。
。
13. 向
分析:解題的關鍵是抓住
設
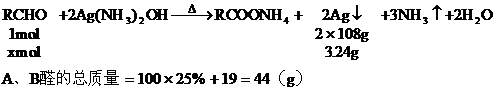
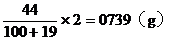
混合醛的平均分子量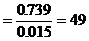
設A醛、B醛分子式分別為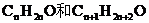 ,則A、B的分子量分別為14n+16、14n+30
,則A、B的分子量分別為14n+16、14n+30
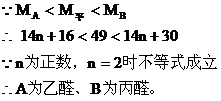
14. 今有分子組成相差1個碳原子和若干個氫原子的兩種單烯烴的混合物,若取該單烯烴混合物的質量為
(1)試確定原混合烴中兩種單烯烴的分子組成。
(2)為了使該混合烴對氧氣的密度≥
分析:
(1)取單烯烴混合物為
∴混合烴的平均分子量≤42
∴該混合烴的組成C2H4和C3H6
(2)該混合烴的平均分子量≥33.6(1.05×32)
設混合烴中C3H6為x mol,C2H4為y mol
則 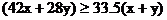
解得 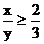
又∵燃燒產物增加的物質的量由C3H6燃燒所致
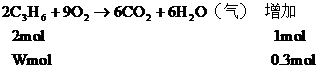
∴ 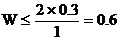
∴C2H4的物質的量≥0.4
∴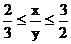
15. 鎂條在空氣中燃燒生成氧化鎂和氮化鎂。將燃燒后的產物溶解在60毫升濃度為2.0mol/升的鹽酸中,再用20毫升0.5mol/升NaOH溶液中和多余的鹽酸,然后在此溶液中加過量的堿,把氨全部蒸出來,用稀HCl吸收,稀HCl增重
分析:此題涉及反應較多,如按常規計算非常復雜,如巧用電荷守恒法可使計算大為簡化。
該題反應變化的圖式:
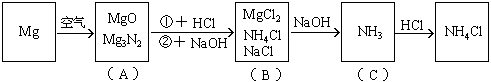
在圖(B)中,根據電荷守恒,有下列關系:
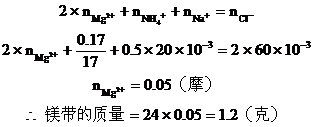
16. 飽和烴A和不飽和烴B在常溫下均為氣體,其中A含C原子數多于B。
(1)將A、B按一定比例混合。
A的分子式
B的分子式
VA∶VB
(2)1mol該混合氣體恰好能使含0.4mol溴的CCl4溶液完全褪色,推斷上述組合中符合該條件的A與B的分子式并填入下表
A的分子式
B的分子式
分析:(1)本題是用計算推理方法確定混合烴的組成。
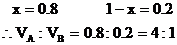
也可用十字交叉來解:
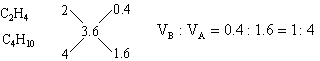
其它組合可依此類推,于是得到:
組合的編號
A的分子式
B的分子式
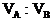
①
C4H10
C2H4
4∶1
②
C4H10
C2H2
4∶1
③
C4H10
C3H6
3∶2
④
C4H10
C3H4
3∶2
(2)
A的分子式
C4H10
C4H10
B的分子式
C2H2
C3H6
17. 有不同濃度的NaOH溶液各取100mL分別通入SO2
分析:SO2與NaOH溶液反應,可能有三種情況:NaOH過量,所得固體為Na2SO3和NaOH的混合物;SO2部分過量,所得固體為Na2SO3和NaHSO3的混合物;SO2極大過量所得固體為NaHSO3,因此本題應首先確定固體的成分。
(1)應用極值法先確定兩個極值
a:設SO2與NaOH完全作用生成Na2SO3
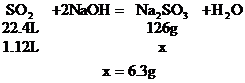
b:設SO2極大過量,最終產物為NaHSO3
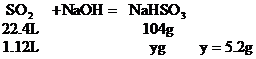
(2)討論確定產物
a:因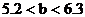 ,所以b g固體為Na2SO3和NaHSO3的混合物
,所以b g固體為Na2SO3和NaHSO3的混合物
b:因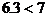 所以
所以
(3)計算
a:第一種情況,設生成Na2SO3為xmol,NaHSO3為ymol
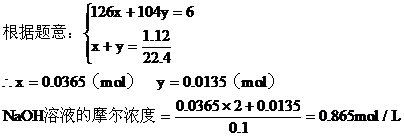
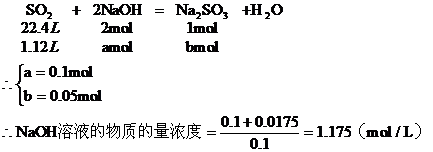
b:第二種情況:因NaOH過量,所以H2SO2完全反應。設參加反應的NaOH為amol,生成Na2SO3為bmol,過量的NaOH為Cmol
18. 已知Cl-與Ag+,每次新生成的AgCl中又有10%見光分解成單質和Cl2,Cl2又可在水溶液中歧化成HClO3和HCl,而這樣形成的Cl-又與剩余的Ag+作用生成沉淀,這樣循環往復,直到最終。現有含1.1molNaCl的溶液,向其中加入足量AgNO3。求最終能生成多少克難溶物(Ag和AgCl)?若最后溶液體積為
[解析]此題為運用數列知識解決化學問題的試題。發生反應為
Ag++Cl-=AgCl↓,2AgCl===2Ag+Cl2,3Cl2+3H2O=HClO3+5HCl由題意可知n(AgCl):n(Ag)=9:1,由2AgCl――Cl2――1/3HClO可知1molAgCl可轉化為HClO31/6mol,因此n(AgCl):n(Ag):n(HClO3)=9:1:1/6=54:6:1,總反應方程式為
60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+,從而求出m(難溶物)=
19. Na2S2O3•5H2O(俗稱海波)是照相業常用的一種定影劑,常采用下法制備:將亞硫酸鈉溶液與硫粉混合共熱,生成硫代硫酸鈉Na2SO3+S=Na2S203,濾去硫粉,再將濾液濃縮、冷卻,即有Na2S2O3•5H2O晶體析出,該法制得的晶體中常混有少量Na2SO3和Na2SO4的雜質。
為測定一種海波晶體樣品的成分,某同學稱取三份質量不同的該樣品,分別加入相同濃度的H2SO4溶液20mL,充分反應后濾出硫,并將濾液微熱(假定生成的SO2全部逸出),測得有關實驗數據如下(標準狀況):
第一份
第二份
第三份
樣品的質量/g
12.60
18.90
28.00
二氧化硫的體積/L
1.12
1.68
2.24
硫的質量/g
1.28
1.92
2.56
(1)樣品與硫酸可能發生反應的離子方程式為 ;
(2)根據上表數據分析,該樣品 (填選項字母);
A、只含有Na2S203
B、含有Na2S203和Na2S03
C、含有Na2S203 、Na2S03,和Na2S04三種成分
(3)試計算,該樣品中各成分的物質的量之比?
(4)所加硫酸溶液的物質的量濃度為 ;
(5)若將
試討論:當a在不同取值范圍時,SO2的體積b,并請在下圖中畫出b隨a的變化的曲線。
b(L)
 6.72
6.72
 5.60
5.60
 4.48
4.48
 3.36
3.36
 2.24
2.24







 1.12
1.12
0 0.01 0.02 0.03 0.04 0.05
[解析]這是一道綜合題,題中涉及了混合物反應的計算,過量問題的計算、計算推斷、數據缺省型的計算、范圍討論計算及數形結合計算等。
答案:(1)略。由表中數據分析可知第一份、第二份樣品進行實驗時H2SO4足量,從而求算得出(2)C和(3)n(Na2S2O3):n(Na2SO3):n(Na2SO4)=4:1:1.
(4)由表中數據分析可知第三份實驗中H2SO4量不足,求出C(H2SO4)=5.0mol/L。
(5)m樣品/m1=
圖象為
b(L)
 6.72
6.72


 5.60
5.60
 4.48
4.48
 3.36
3.36
 2.24
2.24







 1.12
1.12
0 0.01 0.02 0.03 0.04 0.05
20.硫鐵礦高溫下空氣氧化產生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3
設空氣中N2、O2的含量分別為0.800和0.200(體積分數,以下氣體含量均用體積分數表示),試完成下列各題:
(1)1.00mol FeS2完全氧化,需要空氣的體積(標準狀況)為 L
(2)
(3)用空氣氧化FeS2產生的氣體混合物中,O2的含量為0.0800,計算SO2的含量。
(4)設FeS2氧化產生的氣體混合物為
① 寫出a和b的關系式
② 在右圖中畫出a和b的關系曲線(FeS2氧化時,空氣過量20%)
說明:為方便作圖,縱坐標用13b表示
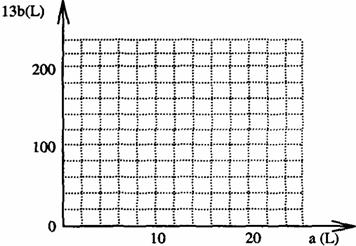
命題意圖:主要考查對元素化合物知識與生產實際的聯系,考查學生嚴密的分析能力、和逆向思維能力及完整的解綜合試題的能力,該題是圖、數結合的由若干小題組合的綜合計算,逐題深入,靈活性強,意在考查學生分析問題和解決問題的實際能力。
解析:(1)4FeS2 → 11O2
4 11 所需O2體積為:
1 mol 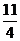 mol
mol
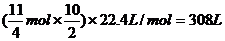
(2)11O2 → 8SO2
11 8
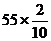 L
y y=
L
y y=
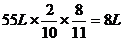
生成的氣體體積為: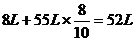
(3)設SO2為X(體積分數),
11O2 → 8SO2
11 8
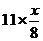 x
x
O2的總體積為:(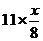 +0.0800) ; N2的總體積為:
+0.0800) ; N2的總體積為: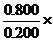 (
(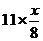 +0.0800);若混合氣體的總體積為1,則N2的總體積也可表示為:1-0.0800-X
+0.0800);若混合氣體的總體積為1,則N2的總體積也可表示為:1-0.0800-X
所以有:4×(11×X/8+0.0800)=1-0.0800-X
X=0.0923
(4)①FeS2氧化產生的氣體混合物為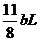 ,N2為 4(
,N2為 4(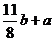 )L,固有:4(
)L,固有:4(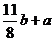 )+ a + b =100 解之得:
)+ a + b =100 解之得:
13b=200-
②由一次函數列表為:
橫坐標(a)L
20
10
3
縱坐標13b
0
100
170
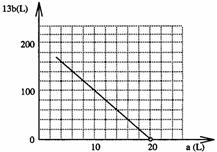
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com