
25.在一定體積的密閉容器中,進行如下化學反應:
CO2(g)+H2(g)  CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列問題:
(1)該反應的化學平衡常數表達式為K= 。
(2)該反應為 反應(選填吸熱、放熱)。
(3)能判斷該反應是否達到化學平衡狀態的依據是 (多選扣分)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),試判斷此時的溫度為 ℃。
24.我國了“神舟”系列載人飛船的成功發射,標志著“炎黃子孫千年飛天夢想實現了”
(1)火箭升空時,由于與大氣層的劇烈摩擦,產生高溫。為了防止火箭溫度過高,在火箭表面涂上一種特殊的涂料 ,該涂料的性質最可能的是 ( )
,該涂料的性質最可能的是 ( )
A.在高溫下不融化 B.在高溫下可分解氣化
C.在常溫下就分解氣化 D.該涂料不可能發生分解
(2)火箭升空需要高能的燃料,經常是用N2O4和N2H4作為燃料,其反應的方程式是:
N2O4 + N2H4 → N2 + H2O 。請配平該反應方程式:
----N2O4 + ----N2H4 → ----N2 + ----H2O
該反應中被氧化的原子與被還原的原子物質的量之比是 。
這個反應應用于火箭推進器,除釋放大量的熱和快速產生大量氣體外,還有一個很大的優點是 。
( 3)為了向宇航員提供氧氣,飛船上有專門的供氧裝置。現有供氧劑過氧化鈉與超氧化鉀(KO2)。
3)為了向宇航員提供氧氣,飛船上有專門的供氧裝置。現有供氧劑過氧化鈉與超氧化鉀(KO2)。
①寫出它們與二氧化碳反應的化學方程式(超氧化鉀與二氧化碳的反應產物與過氧化鈉類似):
__________________ ____;__ _______________________。
_______________________。
②你選擇的供氧劑是: ,原因是:__ __________________________。
__________________________。
23.第一電離能I1是指氣態原子X(g)處于基態時,失去一個電子成為氣態陽離子X+(g)所需的能量。下圖是部分元素原子的第一電離能I1隨原子序數變化的曲線圖(其中12號至17號元素的有關數據缺失)。
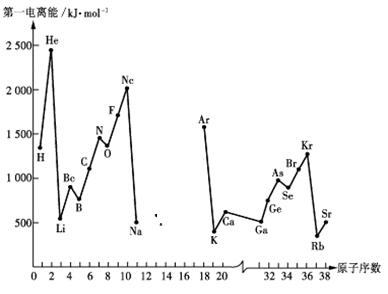
請回答以下問題:
(1)認真分析上圖中同周期元素第一電離能的變化規律,推斷Na--Ar元素中,Al的第一電離能的大小(最小)范圍為 <Al< (填元素符號)。
(2)從上圖分析可知,同一主族元素原子的第一電離能I1變化規律是______________;
(3)上圖中第一電離能最小的元素在周期表中的位置是________________________;
(4)根據對角線規則,Be、Al元素 最高氧化物水化物的性質相似,它們都具有 性,其中Be(OH)2顯示這種性質的離子方程式是:________________
最高氧化物水化物的性質相似,它們都具有 性,其中Be(OH)2顯示這種性質的離子方程式是:________________ ________ ___、______________________________________。
________ ___、______________________________________。
(5)單質C不可能具有的性質是
A.具有良好的導電性
B.熔沸點很高
C.硬度較小
D.易與Br單質反應,形成的化合物分子是極性分子。
22.青石棉(cri cidolite)是世界衛生組織確認的一種致癌物質,是《鹿特丹公約》中受限制的46種化學品之一,青石棉的化學式為:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液處理時,還原產物只有NO,下列說法正確的是 ( )
cidolite)是世界衛生組織確認的一種致癌物質,是《鹿特丹公約》中受限制的46種化學品之一,青石棉的化學式為:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液處理時,還原產物只有NO,下列說法正確的是 ( )
A.青石棉是一種易燃品且易溶于水
B.青石棉的化學組成用氧化物的形式可表示為:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol Na2Fe5Si8O22(OH)2與足量的硝酸作用,至少需消耗6L3mol/LHNO3溶液
D.1mol Na2Fe5Si8O22(OH)2與足量氫氟酸作用,至少需消耗5.5L2mol/LHF溶液
第Ⅱ卷(共84分)
|
 本題共24分)
本題共24分)21.將Zn和Cu用導線連接置于同一稀H2SO4溶液中,下列各敘述中正確的是 ( )
A.正極附近C(H+)逐漸增大
B.正極上產生氣泡
C.正極、負極附近C(H+)基本不變
D.Zn片、Cu片同時冒出氣泡,則說明Zn片不純
20.分子式為C5H10O3的有機物,在一定條件下能發生如下反應:①在濃硫酸存在下,能分別與CH3CH2OH或CH3COOH反應;②在特定溫度及濃硫酸存在下,能生成一種能使溴水褪色的物質;③在特定溫度及濃硫酸存在下,還能生成一種分式為C5H8O2的五元環狀化合物。則C5H10O3的結構簡式為 ( )
A.HOCH2CH2COOCH2CH3
B.HOCH2CH2CH2CH2COOH
C.CH3CH2CH(OH)CH2COOH
D.CH3CH(OH)CH2CH2COOH
19.下列說法中正確 的是(NA為阿伏加德羅常數) ( )
的是(NA為阿伏加德羅常數) ( )
A.78 gNa2O2晶體中所含陰陽離子個數均為2NA
B.1.5 g CH3+中含有的電子數為NA
C.3.4 g氨中含有0.6NA個N-H鍵
D.常溫下,100 mL1 mol·L-1AlCl3溶液中陽離子總數小于0.1NA
18.下列離子方程式正確的是 ( )
A.向Ba(OH)2溶液中滴加 NH4HSO4溶液至剛好沉淀完全:
NH4HSO4溶液至剛好沉淀完全:
Ba2++2OH-+NH4++H++SO42-→BaSO4↓+NH3·H2O+ H2O
B.澄清石灰水與稀鹽酸反應:Ca( OH)2+2H+→Ca2++2H2O
OH)2+2H+→Ca2++2H2O
C.鈉與水反應:2Na+2H2O→2Na++2OH-+H2↑
D.碳酸鋇中加入稀硫酸:BaCO3+2H+→Ba2++CO2↑+H2O
17.將a mol Na和amol Al一同投入m g足量水中,所得溶液密度為dg·㎝-3,該溶液的質量分數為 ( )
A.82a /(46a + m)% B.82000a /(46a + 2m)%
C.8200a /(46a + m)% D.8200a /(69a +2 m)%
16.將SO2通入BaCl2溶液至飽和,未見有沉淀,繼續通入另一種氣體X仍無沉淀,則X可能是 ( )
A.CO2 B.NH3 C.NO2 D.H2S
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com