
2.能量最低原理
現代物質結構理論證實,原子的電子排布遵循構造原理能使整個原子的能量處于最低狀態,簡稱能量最低原理。
構造原理和能量最低原理是從整體角度考慮原子的能量高低,而不局限于某個能級。
1.構造原理
⑴構造原理:隨著核電荷數遞增,大多數元素的電中性基 態原子的電子按右圖順序填入核外電子運動軌道(能級),叫做構造原理。
態原子的電子按右圖順序填入核外電子運動軌道(能級),叫做構造原理。
⑵能級交錯:由構造原理可知,電子先進入4s軌道,后進入3d軌道,這種現象叫能級交錯。
⑶說明:構造原理并不是說4s能級比3d能級能量低(實際上4s能級比3d能級能量高),而是指這樣順序填充電子可以使整個原子的能量最低。也就是說,整個原子的能量不能機械地看做是各電子所處軌道的能量之和。
5.核外電子運動狀態的具體化描述
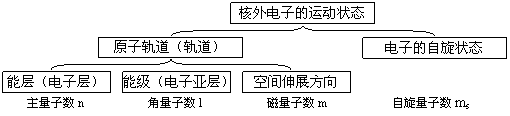
⑴核外電子的運動狀態,由能層、能級、電子云的空間伸展方向、電子的自旋狀態四個方面來描 述,換言之,用原子軌道(或軌道)和電子的自旋狀態來描述。
述,換言之,用原子軌道(或軌道)和電子的自旋狀態來描述。
⑵能層(電子層、用主量子數n表示):按核外電子能量的高低及離核平均距離的遠近,把核外電子的運動區域分為不同的能層(電子層)。目前n的取值為1、2、3、4、5、6、7,對應的符號是英文字母K、L、M、N、O、P、Q。一般地說:n值越大,電子離核的平均距離越遠、能量越高,即E(n=1)<E(n=2)<E(n=3)<E(n=4)<……。
⑶能級(電子亞層、用角量子數l表示):在多電子原子中,同一能層(電子層)的電子,能量也可能不同,還可以把它們分為不同的能級或電子亞層(因為這些不同的能量狀態的能量是不連續的,像樓梯的臺階一樣,因為稱為能級)。用角量子數l來描述這些不同的能量狀態。對于確定的n值,角量子數l的取值有n個:0、1、2、3、(n-1),分別用s、p、d、f……表示。E(ns)<E(np)<E(nd)<E(nf) <……。
⑷電子云的空間伸展方向(用磁量子數m表示):對于確定的能層和能級(n、l已知),能級的能量相同,但電子云在空間的伸展方向不一定相同,每一個空間伸展方向稱為一個軌道,用磁量子數m來描述。不同能層的相同能級,其空間伸展方向數相同,即軌道數相同。
S能級(亞層)是球形,只有1個伸展方向;p能級(亞層)是亞鈴形,有3個伸展方向(三維坐標的三個方向);d、f能級(亞層)形狀比較復雜,分別有5、7個伸展方向。
⑸原子軌道(或軌道):電子在原子核外出現的空間區域,稱為原子軌道。在量子力學中,由能層(電子層、主量子數n)、能級(電子亞層、角量子數l)和電子云的空間伸展方向(磁量子數m)來共同描述。
由于原子軌道由n、l、m決定,由此可以推算出:s、p、d、f能級(亞 層)分別有1、3、5、7個軌道;n=1、2、3、4、…時,其對應電子層包含的軌道數分別為1、4、9、16…,即對于主量子數為n的電子層,其軌道數為n2。
層)分別有1、3、5、7個軌道;n=1、2、3、4、…時,其對應電子層包含的軌道數分別為1、4、9、16…,即對于主量子數為n的電子層,其軌道數為n2。
 ⑹電子的自旋狀態:電子只有順時針和逆時針兩種自旋方向,用自旋量子數ms表示。
⑹電子的自旋狀態:電子只有順時針和逆時針兩種自旋方向,用自旋量子數ms表示。
|

[例1](2010江蘇卷,2)水是最寶貴的資源之一。下列表述正確的是
A.H2O的電子式為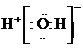
B.4℃時,純水的pH=7
C.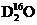 中,質量數之和是質子數之和的兩倍
中,質量數之和是質子數之和的兩倍
D.273K、101kPa,水分子間的平均距離 :
: (氣態)>
(氣態)> (液態)>
(液態)> (固態)
(固態)
[答案]C
[解析]本題主要考查的是有關水的化學基本用語。A項,水是共價化合物,其分子的電子式為 ;B項,溫度升高,水的電離程度增大,
;B項,溫度升高,水的電離程度增大,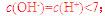 C項,一個
C項,一個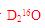
 分子中,其質量數為20,質子數為10,D項,在溫度壓強一定時,它只能呈一種狀態。綜上分析可知,本題選C項
分子中,其質量數為20,質子數為10,D項,在溫度壓強一定時,它只能呈一種狀態。綜上分析可知,本題選C項
[例2](河南省方城五高2010屆高三上學期期中考試)下列敘述正確的 ( )
A. 14N和15N具有相同的質量數 B. 14N和15N所含的電子數不同
C.N4和N2是同素異形體
D. 14N和N4互為同位素
答案 C
|

第2課時 原子核外電子排布規律
4.核外電子運動狀態的形象化描述--電子云:電子在原子核外高速運動,像帶負電的“云霧”籠罩在原子核的周圍,人們形象地把它叫做電子云。電子云實際上是對電子在原子核外空間某處出現的概率多少的形象化描述,圖中的小黑點不表示電子的個數,而是表示電子在該空間出現的機會多少。參見上頁“氫原子基態電子云圖”。
3.電子運動與宏觀物體運動的描述方法的區別
描述宏觀物質的運動:計算某時刻的位置、畫出運動軌跡等。
描述電子的運動:指出它在空間某區域出現的機會的多少。
2. 核外電子運動特征:在很小的空間內作高速運動,沒有確定的軌道。
核外電子運動特征:在很小的空間內作高速運動,沒有確定的軌道。
1.原子結構理論的發展。經歷了以下五個發展階段:
①1803年英國化學家道爾頓家建立了原子學說;
②1903年湯姆遜發現了電子建立了“葡萄干布丁”模型;
③1911年英國物理學家盧瑟福根據α粒子散射實驗提出原子結構的核式模型;
④1913年丹麥科學家玻爾建立了核外電子分層排布的原子結構模型;
⑤20世紀20年代建立了現代量子力學模型。
3.核外電子
核外電子的運動狀態
2. 對于 公式:質量數(A)=質子數(Z)+中子數(N),無論原子還是離子,該公式均適應。
公式:質量數(A)=質子數(Z)+中子數(N),無論原子還是離子,該公式均適應。
原子可用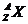 表示,質量數A寫在原子的右上角,質子數Z寫在原子的左下角,上下兩數值的差值即為中子數。原子周圍右上角以及右下角或上面均可出現標注,注意不同位置標注的含義,右上角為離子的電性和電荷數,寫作n
表示,質量數A寫在原子的右上角,質子數Z寫在原子的左下角,上下兩數值的差值即為中子數。原子周圍右上角以及右下角或上面均可出現標注,注意不同位置標注的含義,右上角為離子的電性和電荷數,寫作n ;右下角為微粒中所含X原子的個數,上面標注的是化合價,寫作
;右下角為微粒中所含X原子的個數,上面標注的是化合價,寫作 n形式,注意與電荷的標注進行正確區分,如由氧的一種同位素形成的過氧根離子,
n形式,注意與電荷的標注進行正確區分,如由氧的一種同位素形成的過氧根離子, 可寫作
可寫作 O
O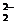 。
。
原子結構及離子結構中各種基本微粒間的關系
|
原子種類 |
微粒之間的關系 |
||
|
中性原子 |
 A AZ |
原子序數=核電荷數=核內質子數= 核外電子數 |
質量數=質子數+中子數 |
|
陽離子 |
 A n+ A n+
|
原子序數=核電荷數=核內質子數=核外電子數+n |
|
|
陰離子 |
 A m- A m-Z |
原子序數=核電荷數=核內質子數=核外電子數-m |
1. 三個基本關系
(1)數量關系:質子數 = 核電荷數 = 核外電子數(原子中)
(2)電性關系:
①原子中:質子數=核電荷數=核外電子數
②陽離子中:質子數>核外電子數 或 質子數=核外電子數+電荷數
③陰離子中:質子數<核外電子數 或 質子數=核外電子數-電荷數
(3)質量關系:質量數 = 質子數 + 中子數
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com