
2.我市是第六個國家級“光谷”,下列過程屬于物理變化的是
A.二氧化硅(SiO2)與焦炭制粗硅(Si) B.氫氣與四氯化硅(SiCl4)制純硅(Si)
C.太陽能熱水器中冷水變熱水 D.在催化劑作用下太陽能光解水制氫
1.“詩畫瘦西湖,人文古揚州”是我市的旅游宣傳語,清澈的瘦西湖水屬于
A.混合物 B.純凈物 C.單質 D.化合物
32.(6分)在一次化學課外活動中,化學老師給小亮同學30g NaCl固體樣品(含有CuCl2雜質),要求用所提供的試劑:一定質量分數的氫氧化鈉溶液、氫氧化鉀溶液、稀鹽酸各100g,通過實驗將CuCl2除去(不引進其它雜質)并測出其中所含氯化銅的質量分數。小亮同學通過思考并查閱有關溶解度數據以后,很快完成了老師交給的任務。他的方法是:將30g NaCl樣品加入100g水中,固體全部溶解后再逐漸加入所選試劑,當加入的試劑質量為56g時,恰好完全反應,測得生成的沉淀為4.9g。請回答:
(1)該同學所選用的試劑是 。
(2)該30g NaCl樣品中所含氯化銅的質量分數是多少?(要求寫出計算過程)
(3)當恰好完全反應時,所得溶液的質量是多少?(要求寫出計算過程)
再次提醒:所有的答案都填(涂)到答題卡上,答在本卷上的答案無效。
31.(6分)據有關專家介紹,用醋酸蒸氣對空氣進行消毒可以有效地預防流感。某學校在每間教室用120g10%的醋酸(CH3COOH) 水溶液加熱制取蒸氣進行空氣消毒處理。請計算:
(1)醋酸的相對分子質量為 。
(2)120g10%的醋酸溶液中含水 g。
(3)120g10%醋酸溶液中氧元素的質量是多少?(要求寫出計算過程)
30.(7分)為了延緩蛋糕等食品的氧化,生產廠家在包裝袋中加入了一種除氧劑。該除氧劑是一種或兩種常見單質的粉末狀固體,未變質時呈黑色,失效后帶有紅褐色。某化學課外興趣小組為了確定該除氧劑的主要成分,進行了如下探究。
提出問題:假設①:該除氧劑的主要成分是活性炭;假設②:該除氧劑的主要成分是活性鐵粉;假設③:該除氧劑的主要成分是活性炭和活性鐵粉的混合物。
設計方案并進行實驗:同學們對實驗作了如下設計并進行了實驗:將一包未變質的除氧劑分成兩份,一份加入到氯化銅溶液中,一段時間后溶液顏色變成淺綠色且出現紫紅色固體,說明假設 一定是不正確的;另一份加入到足量的稀鹽酸中,發現產生大量氣泡且一段時間后沒有固體剩余,說明假設 是正確的。
反思與評價:(1)為了驗證該除氧劑是否含有活性鐵粉,可以采用的一種物理方法是 ;(2)下列有關說法正確的有 (填字母)。
A.凡是能與氧氣反應的固體物質均可作為食品的除氧劑
B.該除氧劑可用于牛奶、果汁等飲料的保鮮
C.米飯、蛋糕等食品的腐敗變質屬于緩慢氧化
D.一些食品中放小包裝袋的氧化鈣,主要是利用其能吸收空氣中的氧氣
拓展:
(1)若某除氧劑主要成分為活性鐵粉,由于鐵與氧氣、水蒸氣反應生成鐵銹(用Fe2O3·3H2O表示),從而達到吸收包裝袋中的氧氣、延長食品保質期的目的。
①生成鐵銹的化學方程式為 。
②已知該除氧劑含活性鐵粉的質量為1.4 g,則該除氧劑最多能夠吸收氧氣 g。
(2)我們日常使用的鐵制品容易發生銹蝕。請說出一種防止鐵制品銹蝕的方法: 。
29.(7分)氨氣是一種無色有刺激性氣味、極易溶于水、密度比空氣小的氣體。某學習小組在探究活動中要制取一定量的氨氣,該小組查閱資料后,得知以下兩種方法可以制取氨氣:
第一種方法:氮氣與氫氣在高溫、高壓、催化劑的條件下生成氨氣;
第二種方法:氯化銨固體和熟石灰粉末在加熱條件下生成氨氣。
(1)該小組同學沒有選擇第一種方法制取氨氣的原因是 。
(2)在下圖所示裝置中,制取氨氣的裝置是 ,理由是 ;收集氨氣的裝置是 ,理由是 。
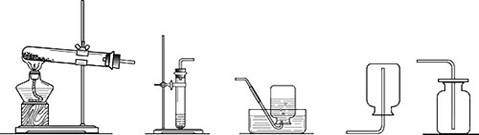

A B C D E
(3)請寫出上圖所示裝置中標有序號的儀器名稱:① ②
28.(6分)已知:A、B、C、D、E、F是六種常見的物質,其中A是黑色固體,B是無色無味的劇毒氣體,C是紫紅色金屬單質。它們之間的轉化關系如圖:

請回答:
(1)寫出下列物質的化學式:B 、C 、E 。
(2)寫出反應①的化學反應方程式: 。
(3)寫出反應②的化學反應方程式: ;該反應屬于基本反應類型中的 反應。
27.(6分)水是生命之源、萬物之基,是人類寶貴的自然資源,我們每個人都要關心水、愛護水、節約用水。
(1)我國規定生活飲用水的水質必須達到下述四項指標:a.不得呈現異色 b.不得有異味 c.應澄清透明 d.不得含有細菌和病毒。其中“c指標”可以通過 操作達到。
(2)生活中可以采用 區分硬水和軟水,可以通過 的方法降低水的硬度。
(3)水的用途廣泛,許多化學實驗中用到水,請你列舉一例:
(4)下列各種水中屬于純凈物的是 (填序號)。
①礦泉水 ②自來水 ③蒸餾水 ④汽水 ⑤糖水
(5)小明家長期飲用“××牌純凈水”,專家認為這是不科學的,理由是 。
26.(3分)鎂是一種常見的金屬,中學化學中經常使用鎂的單質及其化合物進行實驗。
(1)在試管中放入一小塊鎂條,加入5mL稀鹽酸,我們除了觀察到反應劇烈、產生大量氣泡外,還能觀察到的現象是 。
(2)向MgO與過量的鹽酸反應生成的MgCl2溶液中滴加濃度比較大的NaOH溶液時,剛開始沒有出現白色沉淀(Mg (OH)2),隨著氫氧化鈉溶液的加入,逐漸出現白色沉淀。請回答下列問題:
①剛開始沒有出現白色沉淀的原因是 (用化學方程式表示) 。
②生成白色沉淀(Mg (OH)2)的化學方程式為: 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com