

請(qǐng)回答下列問(wèn)題:
(1) 試劑1是________,試劑2是________(均填化學(xué)式)。
(2) A至H中,能發(fā)生銀鏡反應(yīng)的是(寫(xiě)該物質(zhì)的結(jié)構(gòu)簡(jiǎn)式)_____ _____。
(3) G和D的結(jié)構(gòu)簡(jiǎn)式分別是:G______________ ;D_____________。
(4) 反應(yīng)類型:C→E ,E→F 。
(5) E轉(zhuǎn)化為F的反應(yīng)方程式是____________________________________________。
(6) 請(qǐng)寫(xiě)出符合下列條件的α-松油醇的同分異構(gòu)體的結(jié)構(gòu)簡(jiǎn)式
①有一個(gè)六元環(huán) ②能發(fā)生銀鏡反應(yīng)③含一個(gè)丙基
、
。
29.(22分)α-松油醇可經(jīng)以下路線合成,小方框中的每一字母各代表一種有機(jī)物:
28.(14分)A~N均為中學(xué)化學(xué)中的常見(jiàn)物質(zhì),其中A是日常生活中不可缺少的物質(zhì),也是化工生產(chǎn)上的重要原料,單質(zhì)M是目前使用量最大的金屬,常溫下B、E、F為氣體,G為無(wú)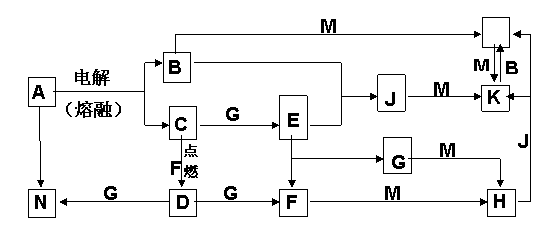 色液體,這些物質(zhì)在一定條件下存在如下轉(zhuǎn)化關(guān)系,其中有些反應(yīng)物或生成物已經(jīng)略去。回答下列問(wèn)題:
色液體,這些物質(zhì)在一定條件下存在如下轉(zhuǎn)化關(guān)系,其中有些反應(yīng)物或生成物已經(jīng)略去。回答下列問(wèn)題:
(1) H的化學(xué)式為_(kāi)_________ ,D的電子式 ______________________
(2)B與N反應(yīng)的離子方程式為_(kāi)_________________________________。
(3)D與G反應(yīng)的化學(xué)方程式為_(kāi)_________________________________。
(4)I可用于凈化水,其原因?yàn)開(kāi)_________________________ _________ _______________________________________。(用相關(guān)的反應(yīng)方程式和簡(jiǎn)要文字回答)。
(5)通常狀況下, 1 g氣體E在氣體F中完全燃燒生成液態(tài)G時(shí)放出熱量為a kJ,請(qǐng)寫(xiě)出表示E燃燒熱的熱化學(xué)方程式____________ ________________。
(6)I與NaOH溶液反應(yīng)生成的沉淀再與NaOH和NaClO的混合液作用,是制備理想的綠色水處理劑(Na2MO4)的一種方法,試寫(xiě)出此反應(yīng)的化學(xué)方程式_______________________。

② 實(shí)驗(yàn)過(guò)程中,使用分液漏斗滴加濃硫酸的操作是____________________________。
⑵ 將SO2氣體分別通入下列溶液中:
① 品紅溶液,現(xiàn)象是_____________________。
② 溴水溶液,現(xiàn)象是_____________________。
③ 硫化鈉溶液,現(xiàn)象是____________________。
⑶ 有一小組在實(shí)驗(yàn)中發(fā)現(xiàn),SO2氧化產(chǎn)生緩慢,以致后續(xù)實(shí)驗(yàn)現(xiàn)象很不明顯,但又不存在氣密性問(wèn)題。請(qǐng)你推測(cè)可能的原因并說(shuō)明相應(yīng)的驗(yàn)證方法(可以不填滿):
① 原因________________,驗(yàn)證方法___________________ ______________。
②原因____________,驗(yàn)證方法_______________________ _______________。
③ 原因____________ ,驗(yàn)證方法__________ ____。
27.(12分)研究性學(xué)習(xí)小組進(jìn)行SO2制備及性質(zhì)探究實(shí)驗(yàn)。
⑴ 根據(jù)反應(yīng):Na2SO3(固) + H2SO4(濃) == Na2SO4 + SO2↑+H2O,制備SO2氣體。
① 用下列簡(jiǎn)圖,在答題卡的方框中畫(huà)出制備并收
集SO2的實(shí)驗(yàn)裝置(含試劑)示意圖。
② 步驟Ⅱ的目的是除鐵。具體操作是:滴加H2O2溶液,稍加熱;當(dāng)Fe2+轉(zhuǎn)化完全后,慢慢加入Cu2(OH)2CO3粉末,攪拌,以控制溶液pH=3.5;加熱煮沸一段時(shí)間,過(guò)濾,用稀硫酸酸化濾液至pH=1。控制溶液pH=3.5的原因是______________ 。
③ 步驟Ⅲ的目的是得到CuSO4?5H2O晶體。操作是 ___ ,過(guò)濾,水浴加熱烘干。水浴加熱的特點(diǎn)是_______________ 。
⑵ 探究氧化銅的性質(zhì):
① 取A、B兩支試管,往A中先加入適量CuO粉末,再分別向A 和B中加入等體積的3% H2O2溶液,只觀察到A中有大量氣泡,結(jié)論是________ 。
② 為探究試管A中反應(yīng)的速率,收集氣體并測(cè)定其體積必需的實(shí)驗(yàn)儀器有: __________________ 。
 工業(yè)CuSO4
CuSO4溶液
工業(yè)CuSO4
CuSO4溶液 
 CuSO4?5H2O …… CuO
CuSO4?5H2O …… CuO
① 步驟I的目的是除不溶性雜質(zhì),其操作是 。
26.(12分) 氧化銅有多種用途,如用作玻璃著色劑、油類脫硫劑等。為獲得純凈的氧化銅以探究其性質(zhì),某同學(xué)用工業(yè)硫酸銅(含硫酸亞鐵等雜質(zhì))進(jìn)行如下實(shí)驗(yàn):
|