
8.答案:C
解析:SO2轉化為SO3為可逆反應,不可能完全轉化為SO3;如果縮小體積則會增大壓強,平衡向右移動;如果充入稀有氣體,增大壓強,平衡不移動。SO2消耗速率代表正反應速率,O2的生成速率代表逆反應速率,平衡時為兩倍關系;SO2平衡濃度不一定等于O2的兩倍,因為起始濃度不一定是兩倍。
7.答案:C
解析:因此反應是等體積反應,平衡前后壓強不變,故選項B錯;化學平衡最根本的標志是正逆反應的速率相等,故A錯;選項D中表示的都是逆反應速率。
6.答案:AC
解析:題設的關鍵信息是反應達平衡后容器體積增大一倍,應轉換為(1)條件變化的瞬間A、B的濃度均為原來的50%;(2)容器內壓強減小為原來的1/2。本題的設問多項比較綜合,但只要抓住達新平衡時B的濃度由50%→60%這第2個關鍵信息,說明生成物B的物質的量、質量、質量分數都增大了,平衡正向移動,反應物A的轉化率增大,并且由壓強減小,平衡向體積增大方向移動,推出a<b。
5.答案:BD
解析:由圖給信息可知,隨著溫度的升高,平衡混合氣中G的體積分數減小,說明該反應為吸熱反應;由圖知,在相同溫度下,壓強增大,說明平衡混合氣中G的體積分數也增大,說明該反應是氣體分子數增大的反應,即a<b。
4.答案:A
解析:對有氣體參加的反應,如果反應前后氣體分子數目不變,壓強改變時,則平衡不移動,如果反應前后氣體分子數目發生了變化,壓強改變時,則平衡移動。四個選項中只有A是氣體分子數不變的反應。
3.答案:C
解析:減小壓強,氣體體積增大,反應物和生成物的濃度都減小,正逆反應速率都減小,正反應是縮小氣體體積的反應,平衡應向擴大氣體體積的方向移動。
2.答案:AB
解析:正反應是氣體物質的量減小的反應,容器內壓強不隨時間變化時,即氣體的物質的量不再變化,各物質的濃度也不再變化,表明該反應達到了平衡狀態。
1.答案:C
解析:溫度降低,正反應速率和逆反應速率都減小;因正反應是放熱反應,降低溫度,平衡向放熱反應方向移動。
25.(1994年上海,13)已知氯水中有如下平衡:Cl2+H2O HCl+HClO,常溫下,在一個體積為50 mL的針筒里吸入40
mL氯氣后,再吸進10 mL水。寫出針筒中可能觀察到的現象
。
HCl+HClO,常溫下,在一個體積為50 mL的針筒里吸入40
mL氯氣后,再吸進10 mL水。寫出針筒中可能觀察到的現象
。
若將此針筒長時間放置,又可能看到何種變化 ;試用平衡觀點加以解釋 。
●答案解析
24.(1996年上海,30)將等物質的量的A、B、C、D四種物質混合,發生如下反應:
aA+bB cC(s)+dD,當反應進行一定時間后,測得A減少了n mol,B減少了
cC(s)+dD,當反應進行一定時間后,測得A減少了n mol,B減少了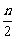 mol,C增加了
mol,C增加了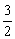 n mol,D增加了n mol,此時達到化學平衡。
n mol,D增加了n mol,此時達到化學平衡。
(1)該化學方程式各物質的化學計量數為a=__________、b=__________、c=__________、d=__________;
(2)若只改變壓強,反應速率發生變化,但平衡不發生移動,該反應中各物質的聚集狀態:
A__________、B__________、D__________。
(3)若只升高溫度,反應一段時間后,測知四種物質其物質的量又達到相等,則該反應為__________反應(填“放熱”或“吸熱”)。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com