
21.下列敘述正確的是( )
A.將稀氨水逐滴加入稀硫酸中,當溶液pH=7時,c(SO42-)>c(NH4+)
B.兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,則c1=10c2
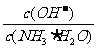 C.pH=11的NaOH溶液與pH=3的醋酸溶液等體積混合,滴入石蕊溶液呈紅色
C.pH=11的NaOH溶液與pH=3的醋酸溶液等體積混合,滴入石蕊溶液呈紅色
D.向0.1 mol/L的氨水中加入少量硫酸銨固體,則溶液中 增大
20.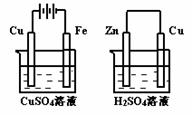 右圖兩個裝置中,溶液體積均為200mL,開始時,電解質溶液的濃度均為0.1mol/L,工作一段時間后,測得導線上都通過了0.02mol
e一,若不考慮溶液體積的變化,則下列敘述正確的是( )
右圖兩個裝置中,溶液體積均為200mL,開始時,電解質溶液的濃度均為0.1mol/L,工作一段時間后,測得導線上都通過了0.02mol
e一,若不考慮溶液體積的變化,則下列敘述正確的是( )
A.在①中Cu棒為陽極;在②中Cu棒為負極
B.電極上析出物質的質量:①<②
C.電極反應式:①中陽極:4OH一一4e一= 2H2O+O2↑;
|
|
D.溶液的pH:①不變;②增大
19.相同溫度下,100mL 0.01mol/L的醋酸溶液與10mL 0.1mol/L的醋酸溶液相比較,下列數值前者大于后者的是( )
A.中和時所需NaOH的量 B.c(H+)
C.c(OH-) D.c(CH3COOH)
18.工業上制備純硅反應的熱化學方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某溫度、壓強下,將一定量反應物通入密閉容器進行以上反應(此條件下為可逆反應),下列敘述正確的是(
)
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某溫度、壓強下,將一定量反應物通入密閉容器進行以上反應(此條件下為可逆反應),下列敘述正確的是(
)
A. 反應過程中,若增大壓強能提高SiCl4的轉化率
B. 若反應開始時SiCl4為1mol,則達平衡時,吸收熱量為QkJ
C. 反應至4min時,若HCl濃度為0.12mol/L,則H2的反應速率為0.03mol/(L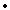 min)
min)
D. 當反應吸收熱量為0.025QkJ時,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反應
16.在恒溫恒容下,對反應CO2(g)+H2(g)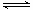 CO(g)+H2O(g)進行甲、乙、丙、丁四組實驗,實驗起始時放入容器內各組分的物質的量見下表
CO(g)+H2O(g)進行甲、乙、丙、丁四組實驗,實驗起始時放入容器內各組分的物質的量見下表
|
|
CO2 |
H2 |
CO |
H2O |
|
甲 |
amol |
amol |
0mol |
0mol |
|
乙 |
2amol |
amol |
0mol |
0mol |
|
丙 |
0mol |
0mol |
2amol |
2amol |
|
丁 |
amol |
0mol |
amol |
amol |
上述四種情況達到平衡后,n(CO)的大小順序是( )
A.丙>乙=丁>甲 B.乙>丁>甲>丙
C.乙=丁>丙=甲 D.丁>丙>乙>甲
17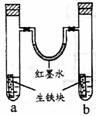 .右圖裝置中,U型管內為紅墨水,a、b試管內分別盛有食鹽水和氯化銨溶液,各加入生鐵塊,放置一段時間。下列有關描述錯誤的是( )
.右圖裝置中,U型管內為紅墨水,a、b試管內分別盛有食鹽水和氯化銨溶液,各加入生鐵塊,放置一段時間。下列有關描述錯誤的是( )
A.生鐵塊中的碳是原電池的正極
B.紅墨水柱兩邊的液面變為左低右高
C.兩試管中相同的電極反應式是:Fe -2e-= Fe2+
D.a試管中發生了吸氧腐蝕,b試管中發生了析氫腐蝕
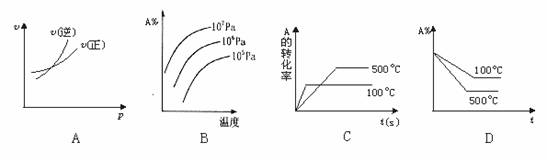
15.對于可逆反應A(g)+2B(g) 2C(g) ΔH﹥0,下列圖象中正確的是( )
2C(g) ΔH﹥0,下列圖象中正確的是( )
14. 取濃度相同的NaOH和HCl溶液,以3∶2 體積比相混合,所得溶液的pH =12,則原溶液的濃度為( )
A.0.01 mol•L-1 B.0.017 mol•L-1 C.0.05 mol•L-1 D.0.50 mol•L-1
13.下列實驗基本操作正確的是 ( )
A.用堿式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.配制一定濃度的氫氧化鈉溶液時,將氫氧化鈉固體放在紙片上稱量
C.將滴管垂直伸進試管內滴加液體。
D.用玻璃棒蘸取溶液滴到濕潤的pH試紙上,測其pH
12.下列描述違背化學原理的是( )
A.“冰,水為之,而寒于水”說明相同質量的水和冰,水的能量高
B.反應A(g)+3B(g) 2C(g)達平衡后,溫度不變,增大壓強,平衡正向移動,平衡常數K值增大
2C(g)達平衡后,溫度不變,增大壓強,平衡正向移動,平衡常數K值增大
C.SO2的催化氧化是一個放熱的反應,升高溫度,反應速率加快
D.在KI溶液中加入氯化銀固體,一段時間后沉淀變成黃色,說明同溫度下Ksp(AgI)< Ksp(AgCl)
11.常溫下,0.1mol·L-1某一元酸(HA)溶液中=1×10-8,下列敘述正確的是( )
A.該一元酸溶液的pH=1
B.該溶液中HA的電離度為 1% C.該溶液中水的離子積常數為1×10-22 D.若加水稀釋,則C(OH-)/C(H+)將減小
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com