
高考熱點專題測試卷:專題三 電解質溶液
說明:本試卷共分兩卷,第Ⅰ卷為選擇題,把正確答案序號填在題后答題卡內.第Ⅱ卷為非選擇題,直接在本卷內作答.
第Ⅰ卷(共83分)
一、選擇題:每小題3分,5小題共15分.每小題只有一個選項正確.把正確選項的代號填在題后答題卡中.
1. 、
、 、
、 、
、 、
、 、
、 分別表示兩種一元弱酸的物質的量濃度、電離度和溶液中
分別表示兩種一元弱酸的物質的量濃度、電離度和溶液中 .如果已知
.如果已知 ,
, ,則
,則 和
和 的關系為( )
的關系為( )
A. B.
B. C.
C. D.無法確定
D.無法確定
2. 氨水10 mL,加蒸餾水稀釋到
氨水10 mL,加蒸餾水稀釋到
①電離度增大 ② 增大 ③
增大 ③ 數目增多
數目增多
④ 增大 ⑤導電性增強 ⑥
增大 ⑤導電性增強 ⑥ 增大
增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
3.某一元弱酸溶液中存在 個弱酸分子和
個弱酸分子和 個
個 離子,該酸的電離度為( )
離子,該酸的電離度為( )
A.1.0% B.2.0% C.5.0% D.10.0%
4.一元弱酸HCN在一定條件下電離度為a,已知此溶液中有1 mol HCN分子、則此溶液中溶質微粒的物質的量之和為( )
A. B.
B.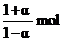 C.
C. D.
D.
5.下列說法一定正確的是( )
A.強電解質溶液的導電性比弱電解質溶液的導電性強
B. 投入水中,導電性較弱,故它是弱電解質
投入水中,導電性較弱,故它是弱電解質
C.弱電解質溶液中存在兩種共價化合物分子
D.氯水能導電,所以 也是電解質
也是電解質
二、選擇題:本題包括8小題,每小題4分,共32分.每小題有一個或二個選項符合題意.若正確答案只包括一個選項,多選時,該題為0分;若正確答案包括兩個選項,只選一個且正確的給2分,選兩個且都正確的給4分,但只要選錯一個,該題就為0分.把正確選項的代號填在題后答題卡中.
6.在不斷攪拌和研磨下,把 溶液逐滴加入200 mL 0.010 mol/LKI溶液中,把制得的AgI溶膠等分為6份,分別加入相同物質的量濃度的下列溶液:
溶液逐滴加入200 mL 0.010 mol/LKI溶液中,把制得的AgI溶膠等分為6份,分別加入相同物質的量濃度的下列溶液:
① ②
② ③
③ ④NaCl ⑤
④NaCl ⑤ ⑥
⑥
則引起凝聚所需上述溶液的體積大小順序是( )
A.②<①<③<⑥<⑤<④ B.②<⑥<⑤<①<③<④
C.②<⑥=①<⑤=③<④ D.⑥<②<⑤<①<③<④
7.已知由 溶液和稍過量的KI溶液制得的AgI溶液,跟
溶液和稍過量的KI溶液制得的AgI溶液,跟 溶液相混合時,析出AgI和
溶液相混合時,析出AgI和 的混合沉淀.由此可知( )
的混合沉淀.由此可知( )
A.該AgI膠粒帶正電荷 B.該AgI膠粒電泳時向陽極移動
C.該AgI膠粒帶負電荷
D. 膠粒電泳時向陽極移動
膠粒電泳時向陽極移動
8.在室溫下進行中和滴定,酸和堿恰好完全反應時,以下說法一定正確的是( )
A.參加反應的酸和堿的物質的量相等
B.參加反應的酸中的 離子總量和堿中
離子總量和堿中 離子總量相等
離子總量相等
C.反應混合液的pH=7
D.能用適當的酸堿指示劑來判斷
9.已知pH=3的酸溶液和pH=11的堿溶液等體積混合后的溶液呈酸性,則發生的反應是( )
A.強堿和弱酸溶液之間的反應 B.強堿和強酸溶液之間的反應
C.較濃酸溶液和較稀堿溶液之間的反應 D.多元強酸和一元強堿之間的反應
10.在 溶液中,下列等量關系成立的是( )
溶液中,下列等量關系成立的是( )
A.
B.
C.
D.
11.下列說法中正確的是( )
A.pH=10與pH=12的NaOH溶液等體積混和,溶液pH=11
B.pH=5的鹽酸溶液稀釋100倍,溶液的pH近似等于7
C.pH=2的 與pH=12的NaOH溶液等體積混和,溶液pH=7
與pH=12的NaOH溶液等體積混和,溶液pH=7
D.pH=12的 與pH=2的HCl溶液等體積混和,混和液pH=7
與pH=2的HCl溶液等體積混和,混和液pH=7
12.物質的量濃度相同的下列物質,在指定的離子濃度的比較中錯誤的是( )
A. :
:
B. :
: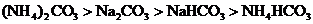
C. :
:
D. :
:
13.乙醇、液氨、水都可以發生自偶電離,如
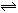
 ,
,
 ,則下列敘述正確的是( )
,則下列敘述正確的是( )
A.乙醇的電離方程式:


B.液氨的離子積常數為: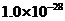 ,則液氨濃度為
,則液氨濃度為
C.若可用與pH相當的定義來規定pOH、 等,則乙醇中與pH相當的為
等,則乙醇中與pH相當的為
D.乙醇中 ,則此時的
,則此時的
三、選擇題:本題包括9個小題,每小題4分,共36分.每小題只有一個選項符合題意.把正確選項的代號填在題后答題卡中.
14.向100 mL0.2 mol/L的NaOH溶液通入 氣體448 mL(標準狀況),所得溶液中各種離子濃度大小順序是( )
氣體448 mL(標準狀況),所得溶液中各種離子濃度大小順序是( )
A. B.
B.
C. D.
D.
15.常溫時,等體積等物質的量濃度的下列物質的溶液中,水的電離度由大到小順序排列的是( )
① ②
② ③
③ ④
④
A.①>②>③>④ B.①>④>③>② C.②>①>③>④ D.②>③>④>①
16.室溫下,水的電離度為( )
A. B.
B. C.
C. D.
D.
17.水是極弱的電解質,在室溫下,平均每n個水分子中只有1個水分子發生電離,則n值為( )
A. B.
B. C.
C. D.55.6
D.55.6
18.pH=3的二元弱酸 溶液與V L pH=11的NaOH溶液混合后,混合液的pH=7.下列判斷正確的是( )
溶液與V L pH=11的NaOH溶液混合后,混合液的pH=7.下列判斷正確的是( )
A.溶液的總體積為2 VL
B.溶液中
C.溶液中 D.溶液中
D.溶液中
19.對于難溶鹽MX(弱電解質),其飽和溶液的 和
和 離子的物質的量濃度之間的關系近似于水的離子積
離子的物質的量濃度之間的關系近似于水的離子積 (
( ,存在著
,存在著 的關系(K為常數).現將足量的AgCl固體分別放入下列物質中,AgCl的溶解度由大到小排列的順序是( )
的關系(K為常數).現將足量的AgCl固體分別放入下列物質中,AgCl的溶解度由大到小排列的順序是( )
① 溶液 ②40 mL 0.03 mol/LHCl ③
溶液 ②40 mL 0.03 mol/LHCl ③ 溶液
溶液
④ 溶液 ⑤10 mL蒸餾水
⑥
溶液 ⑤10 mL蒸餾水
⑥ 溶液
溶液
A.②>③>④>⑥>⑤>① B.①>⑥>⑤>②>④>③
C.①>②>③>④>⑤>⑥ D.③>②>④>⑥>①>⑤
20.兩種pH不同的NaOH溶液,其pH分別為8和10,將這兩種溶液等體積混合后溶液的[ ]最接近于( )
]最接近于( )
A. B.
B.
C. D.
D.
21.分別將等pH或等物質的量濃度的鹽酸和醋酸等體積混合,加入足量鎂,產生 的體積(同溫同壓下測定)的變化圖示如下:
的體積(同溫同壓下測定)的變化圖示如下:

其中正確的是( )
A.①③ B.②④ C.①②③ D.①②③④
22.已知一定溫度下的弱電解質的稀溶液,當加水稀釋使物質的量濃度變為原來的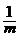 時,其電離度將增大到原溶液電離度的
時,其電離度將增大到原溶液電離度的 倍.現有pH=2的某一元弱酸溶液10 mL,加水至
倍.現有pH=2的某一元弱酸溶液10 mL,加水至
A.等于4 B.在3~4之間 C.等于3 D.在2~3之間
答題卡
題號
1
2
3
4
5
6
7
8
9
10
11
分值
3分
3分
3分
3分
3分
4分
4分
4分
4分
4分
4分
選項
題號
12
13
14
15
16
17
18
19
20
21
22
分值
4分
4分
4分
4分
4分
4分
4分
4分
4分
4分
4分
選項
第Ⅱ卷(共67分)
四、本題包括2小題,共15分
23.(7分)有甲、乙兩份等體積的濃度均為 的氨水,pH為11.
的氨水,pH為11.
(1)甲用蒸餾水稀釋100倍,則 的電離平衡將向________(填“促進”或“抑制”)電離的方向移動,溶液的pH將為________(填序號).
的電離平衡將向________(填“促進”或“抑制”)電離的方向移動,溶液的pH將為________(填序號).
A.9~10之間 B.11 C.12~13之間 D.13
(2)乙用 的氯化銨溶液稀釋100倍,稀釋后的乙溶液與稀釋后的甲溶液相比較,pH_________(填“甲大”、“乙大”、“相等”),其原因是_______________________
的氯化銨溶液稀釋100倍,稀釋后的乙溶液與稀釋后的甲溶液相比較,pH_________(填“甲大”、“乙大”、“相等”),其原因是_______________________
_______________.
24.A、B兩種物質都是由氫、氮、氧、鈉四種元素中的任意三種元素所組成,它們的水溶液分別呈酸性或堿性,在同溫下,A溶液的pH大于相同濃度的B溶液的pH(溶液濃度不大于 ),請找出A和B可能有的兩種組合,并且要求當這兩種組合中的B溶液pH相同時,第一種組合的B溶液中的水的電離度小于第二種組合的B溶液中水的電離度.
),請找出A和B可能有的兩種組合,并且要求當這兩種組合中的B溶液pH相同時,第一種組合的B溶液中的水的電離度小于第二種組合的B溶液中水的電離度.
(1)寫出可能有的兩種組合中,A和B的化學式:
第一種組合:A是_________,B是_________; 第二種組合:A是_________,B是_________.
(2)說明pH相等時,第一種組合B溶液中的電離度比第二種混合的B溶液中水的電離度小的原因:________________________.
五、本題包括2小題,共20分
25.(10分)測定海水中溶解氧的步驟如下:w.w.w.k.s.5.u.c.o.m
①水樣的固定:取a mL海水樣迅速加入固定劑 溶液和堿性KI溶液(含KOH),立即塞好塞子,并振蕩均勻,使之充分反應.
溶液和堿性KI溶液(含KOH),立即塞好塞子,并振蕩均勻,使之充分反應.
②酸化:開塞后迅速加適量1∶1硫酸,再迅速塞好塞子,反復振蕩至沉淀完全溶解.
③滴定:向溶液中加入1 mL 0.5%淀粉溶液,再用 的
的 標準溶液滴定至溶液剛好褪色.
標準溶液滴定至溶液剛好褪色.
有關的離子反應如下:



請回答下列問題:
(1)在進行①、②操作時,要注意“迅速”,如果操作緩慢,會使測定結果________(填偏高、偏低或無影響),原因是___________________________.
(2)滴定前,用蒸餾水洗凈滴定管即加入 標準溶液,會使測定結果_______(填偏高、偏低或無影響),原因是__________________________.
標準溶液,會使測定結果_______(填偏高、偏低或無影響),原因是__________________________.
(3)滴定前,未排除滴定管中的氣泡,在滴定過程中氣泡排除,會使測定結果_______(填偏高、偏低或無影響),原因是__________________________.
(4)滴定時消耗了 標準溶液,則水中溶解
標準溶液,則水中溶解 (g/L)的量的計算式為_________.
(g/L)的量的計算式為_________.
26.(10分)對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系.
若

 ,則
,則
式中:K為電離平衡常數,只與溫度有關,[
]為各微粒的平衡濃度.下表是幾種常見弱酸的電離平衡常數(
酸
電離方程式
電離平衡常數K





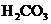










回答下列各問:
(1)K只與溫度有關,當溫度升高時,K值________(填“增大”、“減小”、“不變”).
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關系?
________________________________________________________________________.
(3)若把 、
、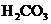 、
、 、
、 、
、 、
、 、
、 、
、 都看作是酸,其中酸性最強的是_________,最弱的是________.
都看作是酸,其中酸性最強的是_________,最弱的是________.
(4)多元弱酸是分步電離的,每一步都有相應的電離平衡常數.對于同一種多元弱酸的 、
、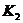 、
、 之間存在著數量上的規律,此規律是________________,產生此規律的原因是_________________________.
之間存在著數量上的規律,此規律是________________,產生此規律的原因是_________________________.
(5)電離平衡常數是用實驗的方法測定出來的.現已經測得 的電離數為a .試表示該溫度下醋酸的電離平衡常數
的電離數為a .試表示該溫度下醋酸的電離平衡常數 _________.
_________.
六、本題包括2小題,共15分w.w.w.k.s.5.u.c.o.m
27.(8分)簡答下列各題:
(1)在工廠里, 和
和 可作焊藥,是何道理?
可作焊藥,是何道理?
(2)在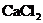 溶液里通入
溶液里通入 ,不會產生
,不會產生 沉淀,但加入氨水,則立即有
沉淀,但加入氨水,則立即有 沉淀產生.
沉淀產生.
(3)試說明工業用 制無水
制無水 時,必須將
時,必須將 在干燥的HCl氣流中加熱脫水是何道理?
在干燥的HCl氣流中加熱脫水是何道理?
(4)土壤的堿性主要是由 水解引起的,用石膏能否改良堿性土壤?為什么?
水解引起的,用石膏能否改良堿性土壤?為什么?
(5)在農業上,草木灰不能跟銨態氮肥、普鈣等混用,試闡述理由.農田在長期施用硫銨后,又要施用一些消石灰,這是為何?
28.(7分)測定某 和
和 混合物的組成,可取兩份各w g的試樣分別溶于水.第一份用甲基橙為指示劑,用
混合物的組成,可取兩份各w g的試樣分別溶于水.第一份用甲基橙為指示劑,用 稀鹽酸在不停搖動時滴定到終點,消耗該酸
稀鹽酸在不停搖動時滴定到終點,消耗該酸 .第二份準確加入
.第二份準確加入 濃度為
濃度為 的NaOH溶液后,再加
的NaOH溶液后,再加 溶液至沉淀完全為止,然后滴入酚酞指示劑,再用
溶液至沉淀完全為止,然后滴入酚酞指示劑,再用 的鹽酸滴定到終點.
的鹽酸滴定到終點.
②若第二份試樣換用甲基橙為指示劑,再用鹽酸滴定至終點,其結果會是_______________________________________________,原因是________________________.
② 在原混合物中質量百分數的計算式為______________.
在原混合物中質量百分數的計算式為______________.
③ 在原混合物中質量百分數的計算式為______________.
在原混合物中質量百分數的計算式為______________.
七、本題包括2小題,共17分
29.(9分)把NaOH、 、
、 三種固體組成的混合物溶于足量水后有
三種固體組成的混合物溶于足量水后有 HCl溶液,加入HCl溶液的體積與生成沉淀
HCl溶液,加入HCl溶液的體積與生成沉淀
的質量關系如圖.試回答:
(2)原混合物中 的質量是________g,
的質量是________g, 的質量是_________g,NaOH的質量是_________g.
的質量是_________g,NaOH的質量是_________g.
(3)Q點HCl溶液加入量是_________mL.
30.(8分)為了度量水中有機物等還原性污染物的含量,通常把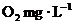 )來表示,稱為該水樣的化學耗氧量(COD).我國明文規定:
)來表示,稱為該水樣的化學耗氧量(COD).我國明文規定: 的污水不得直接排放.
的污水不得直接排放.
為測定某工業為水的COD,實驗如下:量取廢水樣品20.00 mL,加入
 溶液10.00 mL和少量稀
溶液10.00 mL和少量稀 ,在一定條件下充分反應后,再用
,在一定條件下充分反應后,再用 的草酸鈉(
的草酸鈉( )溶液滴定過量的
)溶液滴定過量的 ,達到終點時消耗
,達到終點時消耗 溶液11.00 mL.
溶液11.00 mL.
(1)寫出在酸性介質中 (被還原為
(被還原為 )與
)與 (被氧化為
(被氧化為 )反應的離子方程式________________.
)反應的離子方程式________________.
(2)計算該水樣的COD,寫出計算過程.
(3)如果每次取水樣20.00 mL,加入等體積的 酸性
酸性 溶液,為簡化計算,令滴定過量
溶液,為簡化計算,令滴定過量 時,每消耗
時,每消耗 溶液,就相當于水樣的COD為
溶液,就相當于水樣的COD為 ,該
,該 溶液的物質的量濃度應配制為_________.
溶液的物質的量濃度應配制為_________.
(4)若無需其他計算,只需通過實驗測定下列兩組方案中a與b的值,并直接根據a與b的比值來確定該工業廢水可否直接排放.你認為其中適宜可行的方案是________(填寫序號);并根據你的選擇計算:當 (填寫取值范圍)________時,該工業廢水不能直接排放.
(填寫取值范圍)________時,該工業廢水不能直接排放.
實驗方案





A
a
a
0.100
b
0.100
B
a
20.00
0.100
20.00
b
w.w.w.k.s.5.u.c.o.m
1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C
12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D
21.D 22.C w.w.w.k.s.5.u.c.o.m
23.(1)促進,A (2)甲大
乙用氯化銨溶液稀釋后,[ ]增大很多,使
]增大很多,使 的電離平衡向抑制電離的方向移動;
的電離平衡向抑制電離的方向移動; 發生水解,使稀釋后的乙溶液的[
發生水解,使稀釋后的乙溶液的[ ]增大
]增大
24.(1)第一種組合 A:NaOH B:
第二種組合 A: B:
B:
(2)由于 電離出
電離出 ,使水的電離平衡:
,使水的電離平衡:

 向左移動,使水的電離度小于純水中水的電離度,而
向左移動,使水的電離度小于純水中水的電離度,而 溶液中由于
溶液中由于


由于 電離出的
電離出的 與
與 結合生成弱電解質
結合生成弱電解質 ,從而促進水的電離,使水的電離度比純水中的大.
,從而促進水的電離,使水的電離度比純水中的大.
25.(1)偏高;空氣中的氧氣溶于樣品中
(2)偏高;使 溶液濃度變低,消耗體積偏大
溶液濃度變低,消耗體積偏大
(3)偏高;使最后讀取體積數比實際消耗 溶液體積數大
溶液體積數大
(4)
26.(1)增大w.w.w.k.s.5.u.c.o.m
(2)K值越大,酸性越強
(3)

(4) 上一級電離產生的
上一級電離產生的 對下一級電離有抑制作用
對下一級電離有抑制作用
(5)
27.(1) 和
和 水解均呈弱酸性,可除去金屬表面的氧化物
水解均呈弱酸性,可除去金屬表面的氧化物
(2) 水溶液中[
水溶液中[ ]很小,不會生成沉淀(或弱酸不能生成強酸).加入氨水時,
]很小,不會生成沉淀(或弱酸不能生成強酸).加入氨水時,

 ,使
,使 電離平衡右移,[
電離平衡右移,[ ]增大,產生沉淀(或
]增大,產生沉淀(或 與
與 生成
生成 ,使[
,使[ ]增大
]增大
(3)在HCl氣流中, 抑制
抑制 水解,從而可得到
水解,從而可得到 無水物
無水物
(4)能. ,降低[
,降低[ ],其水解平衡左移,堿性減弱
],其水解平衡左移,堿性減弱
(5) 水解呈堿性,
水解呈堿性, 水解呈酸性,二者混合施用,會促進水解,大量生成易揮發的
水解呈酸性,二者混合施用,會促進水解,大量生成易揮發的 ,從而使氮肥降低肥效
,從而使氮肥降低肥效
 電離呈酸性,與
電離呈酸性,與 混合施用,會產生
混合施用,會產生 或
或 沉淀而喪失肥效.
沉淀而喪失肥效.
硫銨(即硫酸銨)水解呈酸性,長期施用土壤會板結酸化,加消石灰可調節酸度,防止板結.
28.(1)造成測定數值偏高w.w.w.k.s.5.u.c.o.m
(2)
(3)
29.(1) ;
; 、
、
(2)1.90 2.67 5.20
(3)130
分析:(1)因為在濁液中加入HCl溶液至10 mL,沉淀質量一直為 形式存在,繼續加入HCl溶液,
形式存在,繼續加入HCl溶液, 轉變為
轉變為 沉淀,加至30 mL時,
沉淀,加至30 mL時, 全部轉變為
全部轉變為 ,所以在A點的沉淀物為
,所以在A點的沉淀物為 ,在A至B點間,沉淀物為
,在A至B點間,沉淀物為 和
和 的混合物.當加入的HCl溶液超過30 mL時,
的混合物.當加入的HCl溶液超過30 mL時, 和
和 同時溶解.w.w.w.k.s.5.u.c.o.m
同時溶解.w.w.w.k.s.5.u.c.o.m
(2)原混合物中:
 的質量
的質量


 的質量
的質量
NaOH:
①濁液中存在的:
1×0.01 mol
② 消耗的:
消耗的:


③ 消耗的:
消耗的:

0.02 mol×4=0.08 mol
NaOH總質量
(3)從B點開始, 消耗的HCl:0.02 mol×3=0.06 mol
消耗的HCl:0.02 mol×3=0.06 mol
 消耗的HCl:0.02 mol×2=0.04 mol
消耗的HCl:0.02 mol×2=0.04 mol
所消耗HCl溶液的體積為:
Q點HCl溶液總量為:30 mL+100 mL=130 mL
30.(1)
(2)

根據 
過量 為:
為:
20.00 mL水樣消耗 為
為
根據得電子數目相等,則有
相當于 為:
為:
 ,即該水樣的
,即該水樣的
(3)
(4)A,
 www.ks5u.com
www.ks5u.com
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com