
| A. | 容量瓶中原有少量蒸餾水 | B. | 溶解所用的燒杯未洗滌 | ||
| C. | 定容時仰視觀察液面 | D. | 定容時俯視觀察液面 |
分析 A.容量瓶中有少量的蒸餾水,對配制的溶液中溶質的物質的量和最終溶液體積沒有影響;
B.沒有洗滌燒杯和玻璃杯,配制的溶液中溶質的物質的量偏小;
C.定容時仰視容量瓶刻度線,導致加入的蒸餾水體積偏大;
D.定容時俯視容量瓶刻度線,導致加入的蒸餾水在容量瓶刻度線下方,配制的溶液體積偏小.
解答 解:A.用于定容時還需要加入蒸餾水,所以容量瓶中原有少量蒸餾水不影響配制結果,故A錯誤;
B.配制過程中,為了減小誤差,溶解后所用燒杯必須蒸餾水洗滌,若沒有洗滌燒杯,會導致溶質的物質的量偏小,配制的溶液濃度偏低,故B正確;
C.定容時觀察液面仰視,加入的蒸餾水位于容量瓶刻度線上方,導致配制的溶液體積偏大,溶液濃度偏小,故C正確;
D.定容時觀察液面俯視,加入的蒸餾水位于刻度線下方,配制的溶液體積偏小,配制的溶液濃度偏高,故D錯誤;
故選BC.
點評 本題考查了配制一定物質的量濃度方法及誤差分析,題目難度中等,注意掌握配制一定濃度的溶液方法,明確誤差分析的方法與技巧,試題培養了學生的化學實驗能力.


科目:高中化學 來源: 題型:選擇題
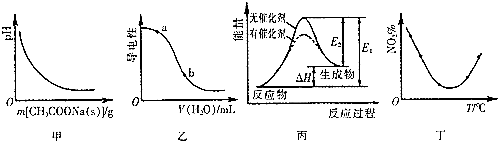
| A. | 圖甲表示向CH3COOH溶液中逐步加入CH3COONa固體后,溶液pH的變化 | |
| B. | 圖乙表示向NH3•H2O溶液中加水時溶液的導電性變化,則NH3•H2O溶液的pH:a<b | |
| C. | 圖丙表示催化劑能改變化學反應的活化能 | |
| D. | 圖丁表示等量NO2在容積相同的恒容密閉容器中,不同溫度下分別發生反應:2NO2(g)?N2O4(g),相同時間后測得NO2含量的曲線,則反應的△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Z>Y>X | |
| B. | 簡單陰離子還原性:Z>Y | |
| C. | 最高價氧化物對應水化物的酸性:Z>Y | |
| D. | W與Z形成的化合物一定是易溶于水的氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=+534 kJ•mol-1 | |
| B. | N2H4(l)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烷和丙烯 | B. | 乙烯和環丙烷 | C. | 乙炔和丁炔 | D. | 甲烷和乙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 請根據所學化學反應原理,解決以下問題:
請根據所學化學反應原理,解決以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.2 g CH30H含有的化學鍵數為0.4NA | |
| B. | 0.1 mol FeCl3水解制得的Fe( OH)3膠體中膠粒數是0.1NA | |
| C. | 標準狀況下,2.24 L Cl2溶于足量水,轉移的電子數為0.1NA | |
| D. | 0.2 g D216O中含有的質子數、中子數和電子數均為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molNa與O2完全反應生成Na2O和Na2O2的混合物,轉移電子NA,生成物中離子總數為2NA | |
| B. | 1LpH=2的NaHSO3溶液中,由水電離的H+數目為0.01 NA 個 | |
| C. | 1.5gCH3+里含有的電子數目為NA | |
| D. | 62g白磷中含有P_P鍵的數目為3NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com