
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=+534 kJ•mol-1 | |
| B. | N2H4(l)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1 |
分析 先計算出1molN2H4(氣態)完全反應生成N2(氣態)和H2O(氣態)放出的熱量,然后寫出該反應的熱化學方程式,再結合H2O(g)=H2O(l)△H=-44KJ.mol-1利用蓋斯定律計算出1molN2H4(氣態)完全反應生成N2(氣態)和H2O(液態)的熱化學方程式,最后對各選項進行判斷即可.
解答 解:0.1mol N2H4(氣態)在O2(氣態)中燃燒生成N2(氣態)和H2O(氣態),則1mol N2H4(氣態)完全反應生成N2(氣態)和H2O(氣態)放出的熱量為:53.4kJ×$\frac{1mol}{0.1mol}$=534kJ,該反應的熱化學方程式為:①N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1,故A、B錯誤;
又知②H2O(g)=H2O(l)△H=-44KJ.mol-1,
根據蓋斯定律,①+②×2可得:N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1,故C錯誤、D正確;
故選D.
點評 本題考查了熱化學方程式書寫、蓋斯定律的應用,題目難度中等,明確蓋斯定律的內容為解答關鍵,注意掌握熱化學方程式的概念及書寫原則,試題培養了學生的靈活應用能力.


 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 生理鹽水的濃度為0.9% | |
| B. | 阿司匹林具有解熱鎮痛的作用 | |
| C. | 垃圾是放錯地方的資源,應分類回收利用 | |
| D. | 甲烷、乙烯和苯在工業上都可通過石油分餾得到 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅為正極,Ag2O為負極 | |
| B. | 如果有1mol電子轉移,就有32.5g Zn參加反應 | |
| C. | 原電池工作時,正極區PH減小 | |
| D. | 鋅為陽極,Ag2O為陰極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 (R、R′可以是氫原子、烴基或官能團)
(R、R′可以是氫原子、烴基或官能團) .
. .
. .
.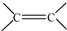 和
和 結構的D的所有同分異構共有7種(不包括順反異構體),寫出其中任意兩種的結構簡式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任兩種).
結構的D的所有同分異構共有7種(不包括順反異構體),寫出其中任意兩種的結構簡式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任兩種).查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 容量瓶中原有少量蒸餾水 | B. | 溶解所用的燒杯未洗滌 | ||
| C. | 定容時仰視觀察液面 | D. | 定容時俯視觀察液面 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2013年,“霧霾”成為年度關鍵詞.近年來,對“霧霾”的防護與治理成為越來越重要的環境問題和社會問題.霧霾主要由二氧化硫、氮氧化物和可吸入顆粒物這三項組成.
2013年,“霧霾”成為年度關鍵詞.近年來,對“霧霾”的防護與治理成為越來越重要的環境問題和社會問題.霧霾主要由二氧化硫、氮氧化物和可吸入顆粒物這三項組成.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com