
 2013年,“霧霾”成為年度關鍵詞.近年來,對“霧霾”的防護與治理成為越來越重要的環境問題和社會問題.霧霾主要由二氧化硫、氮氧化物和可吸入顆粒物這三項組成.
2013年,“霧霾”成為年度關鍵詞.近年來,對“霧霾”的防護與治理成為越來越重要的環境問題和社會問題.霧霾主要由二氧化硫、氮氧化物和可吸入顆粒物這三項組成.分析 (1)C3H6催化還原尾氣中的NO氣體,可以得到無毒的氣體氮氣和二氧化碳;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),據此計算反應的焓變;
(3)電解反應中陰極上發生得電子的還原反應,根據反應原理來回答書寫;
(4)①反應平衡常數K=$\frac{產物平衡濃度系數次冪之積}{反應物平衡濃度系數次冪之積}$;
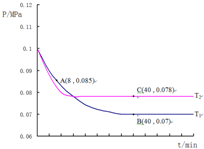
②結合化學三行計算列式,依據圖中A點時,氣體物質的量0.085,依據開始和A點氣體物質的量之比列式計算,轉化率=$\frac{變化量}{起始量}$×100%;
③圖中B點,依據化學三行列式計算用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數計算SO2催化氧化反應在圖中B點的壓強平衡常數;
④先拐先平溫度高,達到平衡所需時間短,溫度越高反應速率越大.
解答 解:(1)C3H6催化還原尾氣中的NO氣體,可以得到無毒的氣體氮氣和二氧化碳,即2C3H6+18NO=6CO2+6H2O+9N2;故答案為:2C3H6+18NO=6CO2+6H2O+9N2;
(2))②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反應的焓變=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,故答案為:-746.5kJ•mol-1;
(3)電解反應中陰極上發生得電子的還原反應,2HSO3-+2H++2e-=S2O42-+2H2O,故答案為:2HSO3-+2H++2e-=S2O42-+2H2O;
(4)①2SO2(g)+O2(g)?2SO3,反應的平衡常數K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,
故答案為:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
②依據化學三行列式計算,設氧氣消耗物質的量為x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
變化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
圖中A點時,氣體物質的量0.085,則$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$,x=0.45a
SO2的轉化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案為:45%;
③圖中B點,依據化學三行列式計算,設氧氣消耗物質的量為y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
變化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B點氣體物質的量為 0.007,則$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$,y=0.9a,
平衡常數K=($\frac{(0.007×\frac{1.8}{0.2a+0.1a+1.8a})^{2}}{(0.007×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×(0.007×\frac{0.1a}{0.2a+0.1a+1.8a})}$)=24300(MPa)-1,
故答案為:24300(MPa)-1;
④圖象分析可知,先拐先平溫度高則T1<T2,C點是平衡狀態,A點反應未達到平衡狀態,其中C點的正反應速率vC(正)與A點的逆反應速率vA(逆)的大小關系為vC(正)>vA(逆)
故答案為:<,>.
點評 本題考查了化學平衡、化學反應速率影響因素的分析應用,圖象變化和數值的計算是解題關鍵,題目難度中等.


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=+534 kJ•mol-1 | |
| B. | N2H4(l)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 請根據所學化學反應原理,解決以下問題:
請根據所學化學反應原理,解決以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 分子式為C10H19O | |
| B. | 同分異構體可能屬于醛類、酮類或酚類 | |
| C. | 能發生取代、氧化、還原反應 | |
| D. | 與氫氣加成后的產物有4種一氯化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.2 g CH30H含有的化學鍵數為0.4NA | |
| B. | 0.1 mol FeCl3水解制得的Fe( OH)3膠體中膠粒數是0.1NA | |
| C. | 標準狀況下,2.24 L Cl2溶于足量水,轉移的電子數為0.1NA | |
| D. | 0.2 g D216O中含有的質子數、中子數和電子數均為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 是合成高聚酚酯的原料,其合成路線(部分反應條件略去)如所示:
是合成高聚酚酯的原料,其合成路線(部分反應條件略去)如所示:
 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$
 .
. $→_{△}^{催化劑}$
$→_{△}^{催化劑}$ +H2O.
+H2O. ,與D互為同分異構體且含有碳碳雙鍵的苯的二取代物有6種,其中核磁共振氫譜為5組峰,且峰面積比為2:1:2:2:1的結構簡式是
,與D互為同分異構體且含有碳碳雙鍵的苯的二取代物有6種,其中核磁共振氫譜為5組峰,且峰面積比為2:1:2:2:1的結構簡式是 (任寫一種).
(任寫一種). )的
)的查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol-OH(羥基)與l mol NH4+中所含電子數均為10NA | |
| B. | 25℃時,100 mL pH=l的稀硫酸中,含有的H+數目為0.01 NA | |
| C. | 室溫下,1 L pH=13的NaOH溶液中,由水電離的OH-離子數目為0.1 NA | |
| D. | 標準狀況下,2.24LNO2和N2O4混合氣體中含0.2 NA個氧原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com