

分析 由流程可知,I中發生2CaCO3+O2+2SO2=2CaSO4+2CO2,反應Ⅳ為NH4HCO3、CaSO4、NH3反應生成碳酸鈣和硫酸銨,發生NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4,可知碳酸鈣可循環使用,Ⅱ中發生SO2+2NH3.H2O=(NH4)2SO3+H2O,Ⅲ中發生CaSO4+4C=CaS+4CO↑,以此來解答.
解答 解:(1)反應Ⅰ的化學方程式為2CaCO3+O2+2SO2=2CaSO4+2CO2,故答案為:2CaCO3+O2+2SO2=2CaSO4+2CO2;
(2)Ⅲ中發生CaSO4+4C=CaS+4CO↑,每生成lmol硫化鈣理論上轉移電子數1mol×[6-(-2)]×NA=8NA;充分利用副產品CO,有人提出以熔融的K2C03為電解質,設計燃料電池,此電池的負極反應為CO+CO32--2e-=2CO2,
故答案為:8NA;CO+CO32--2e-=2CO2;
(3)檢驗反應Ⅱ得到的產品是否因部分被氧化而變質,即檢驗硫酸根離子,則選擇試劑為稀鹽酸、BaCl2溶液,先加鹽酸排除亞硫酸根離子干擾,再加氯化鋇觀察是否生成沉淀,故答案為:稀鹽酸、BaCl2溶液;
(4)由反應Ⅰ、Ⅳ可知,循環使用的物質為CaCO3,故答案為:CaCO3;
(5)二氧化氮與亞硫酸銨反應的離子方程式為2NO2+4SO32-=N2+4SO42-,故答案為:2NO2+4SO32-=N2+4SO42-.
點評 本題考查混合物分離提純的綜合應用,為高頻考點,把握發生的反應、物質的性質、離子檢驗及原電池、氧化還原反應等為解答的關鍵,側重分析與應用能力的考查,題目難度中等.


 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:解答題
 2013年,“霧霾”成為年度關鍵詞.近年來,對“霧霾”的防護與治理成為越來越重要的環境問題和社會問題.霧霾主要由二氧化硫、氮氧化物和可吸入顆粒物這三項組成.
2013年,“霧霾”成為年度關鍵詞.近年來,對“霧霾”的防護與治理成為越來越重要的環境問題和社會問題.霧霾主要由二氧化硫、氮氧化物和可吸入顆粒物這三項組成.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
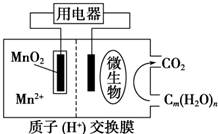
| A. | 正極反應式為MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在電極區放電時發生還原反應 | |
| C. | 放電過程中,H+從正極區移向負極區 | |
| D. | 若用該電池給鉛蓄電池充電,MnO2 電極質量減少8.7g,則鉛蓄電池陰極增重9.6g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 葡萄糖和蛋白質等高分子化合物是人體必需的營養物質 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,預防中毒 | |
| D. | 用二氧化碳生產聚碳酸酯可以減少碳排放,以減緩溫室效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應一段時間后,乙裝置中生成的氫氧化鈉在鐵極區 | |
| B. | 乙裝置中鐵電極為陰極,電極反應式為Fe-2e -=Fe2+ | |
| C. | 通入氧氣的一極為正極,發生的電極反應為O2-4e -+2H2O═4OH- | |
| D. | 反應一段時間后,丙裝置中硫酸銅溶液濃度保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com