
| A. | 1molNa與O2完全反應生成Na2O和Na2O2的混合物,轉移電子NA,生成物中離子總數為2NA | |
| B. | 1LpH=2的NaHSO3溶液中,由水電離的H+數目為0.01 NA 個 | |
| C. | 1.5gCH3+里含有的電子數目為NA | |
| D. | 62g白磷中含有P_P鍵的數目為3NA |
分析 A、鈉和氧氣反應后變為+1價;
B、pH=2的NaHSO3溶液中,HSO3-的電離大于水解;
C、求出CH3+的物質的量,然后根據1molCH3+中含8mol電子來分析;
D、求出白磷P4的物質的量,然后根據1mol白磷中含6molP-P鍵來分析.
解答 解:A、鈉和氧氣反應后變為+1價,故1mol鈉完全反應轉移1mol電子即NA個,而生成的產物無論是氧化鈉還是過氧化鈉,均是2molNa+~1mol陰離子,而1mol鈉反應后變為1molNa+,故所對應的陰離子的物質的量為0.5mol,即產物中離子共1.5NA個,故A錯誤;
B、pH=2的NaHSO3溶液中,HSO3-的電離大于水解,故溶液中的氫離子主要來自于HSO3-的電離,故溶液中水電離出的氫離子小于0.01NA個,故B錯誤;
C、1.5gCH3+的物質的量為0.1mol,而1molCH3+中含8mol電子,故0.1mol中含0.8mol電子即0.8NA個,故C錯誤;
D、62g白磷P4的物質的量為n=$\frac{62g}{124g/mol}$=0.5mol,而1mol白磷中含6molP-P鍵,故0.5mol白磷中含3molP-P鍵即3NA個,故D正確.
故選D.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:多選題
| A. | 容量瓶中原有少量蒸餾水 | B. | 溶解所用的燒杯未洗滌 | ||
| C. | 定容時仰視觀察液面 | D. | 定容時俯視觀察液面 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗目的 | 實驗方案 |
| A | 檢驗亞硫酸鈉是否變質 | 先將亞酸鈉樣品溶于水配成溶液,然后加入足量稀鹽酸酸化,再加入Ba(NO3)2溶液觀察是否生成白色沉淀觀察是否產生白色沉淀 |
| B | 除去苯中混有的苯酚 | 加入適量的溴水充分反應后過濾棄去沉淀 |
| C | 除去NaCl晶體中少量的KNO3雜質 | 先將晶體溶于水配成溶液,然后蒸發結晶并趁熱過濾棄去濾液 |
| D | 檢驗CH3CH2Br中存在的溴元素 | 將CH3CH2Br與NaOH溶液共熱,冷卻后,取出上層水溶液,加入AgNO3溶液,觀察是否產生淡黃色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C、D四種短周期元素的核電荷數依次增大.A原子s軌道電子數是p軌道電子數的兩倍,C原子的L能層中有兩對成對電子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds區,F原子核外有33種不同運動狀態的電子.根據以上信息用相應的元素符號填空:
已知A、B、C、D四種短周期元素的核電荷數依次增大.A原子s軌道電子數是p軌道電子數的兩倍,C原子的L能層中有兩對成對電子,C、D同主族. E、F是第四周期元素,且E位于周期表中ds區,F原子核外有33種不同運動狀態的電子.根據以上信息用相應的元素符號填空:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
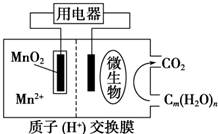
| A. | 正極反應式為MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在電極區放電時發生還原反應 | |
| C. | 放電過程中,H+從正極區移向負極區 | |
| D. | 若用該電池給鉛蓄電池充電,MnO2 電極質量減少8.7g,則鉛蓄電池陰極增重9.6g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應一段時間后,乙裝置中生成的氫氧化鈉在鐵極區 | |
| B. | 乙裝置中鐵電極為陰極,電極反應式為Fe-2e -=Fe2+ | |
| C. | 通入氧氣的一極為正極,發生的電極反應為O2-4e -+2H2O═4OH- | |
| D. | 反應一段時間后,丙裝置中硫酸銅溶液濃度保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | X的一個分子中有32個氫原子 | B. | X的一個分子中含有三個 | ||
| C. | X是一種醇 | D. | X不能使溴的CCl4溶液褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com