
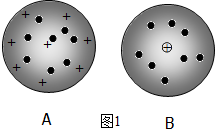
分析 (1)道爾頓認為原子是堅實的、不可再分的實心球,后來湯姆森通過實驗發現了電子,他認為原子中存在更小的微粒,原子是可分的,并提出類似“西瓜”的原子模型,認為電子就像“西瓜子”一樣鑲嵌在帶正電荷的“西瓜瓤”中;盧瑟福的原子核式結構模型:在原子的中心有一個很小的核,叫原子核,原子的全部正電荷和幾乎全部質量都集中在原子核里,帶負電的電子在核外空間里繞著核旋轉;
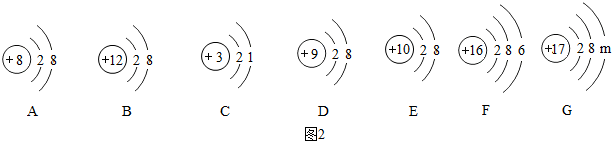
(2)陽離子的核內質子數小于核外電子數;陰離子的核內質子數大于核外電子數;從原子結構示意圖進行分析;
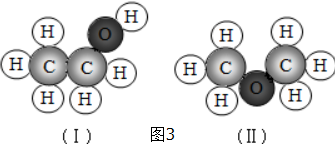
(3)比例模型可以直觀地表示分子的形狀,其碳原子的成鍵情況是確定分子結構的關鍵,碳原子的成鍵情況主要根據與碳原子形成共價鍵的原子的數目確定,原子半徑的關系為C>O>H
解答 解:(1)①道爾頓認為原子是堅實的、不可再分的實心球,后來湯姆森通過實驗發現了電子,他認為原子中存在更小的微粒,原子是可分的,并提出類似“西瓜”的原子模型,認為電子就像“西瓜子”一樣鑲嵌在帶正電荷的“西瓜瓤”中;盧瑟福的原子核式結構模型:原子是一個空心的球,在原子的中心有一個很小的核,叫原子核,原子的全部正電荷和幾乎全部質量都集中在原子核里,帶負電的電子在核外空間里繞著核旋轉.故答案為:A;
②根據湯姆森和盧瑟福理論分析可知,BCDG代表湯姆森的觀點;BCEFGH代表盧瑟福的觀點,故答案為:BCDG;BCEFGH;
(2)①陽離子的核內質子數小于核外電子數;陰離子的核內質子數大于核外電子數;②從C和F的原子結構看,C易失去一個電子,F易得到兩個電子,故它們的化合價分別應該是+1價和-2價;③根據原子結構的表示方法,G的質子數為17,則其有三個電子層,由里向外每層的電子數為2,8,7,故m=7,最外層電子數大于4,易得電子;故答案為:①B;AD;②+1;-2;③7;得到;
(3)CH3-CH2-OH和CH3-O-CH3的化學式相同,但結構不同,不是同種物質;故答案為:相同.
故答案為:(1)①A;②BCDG;BCEFGH;(2)①B;AD;②+1;-2;③7;得到;(3)相同.
點評 本題考查原子、離子、分子的結構知識,基礎性強.


科目:初中化學 來源: 題型:解答題
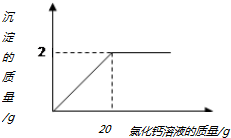 小林在做實驗時發現,實驗室的純堿樣品中混入了少量的食鹽,為測定該純堿樣品中碳酸鈉的含量,小明稱取該純堿樣品2.5g,再滴加氯化鈣溶液至不再產生沉淀,產生沉淀的質量與加入氯化鈣溶液的質量關系如圖所示
小林在做實驗時發現,實驗室的純堿樣品中混入了少量的食鹽,為測定該純堿樣品中碳酸鈉的含量,小明稱取該純堿樣品2.5g,再滴加氯化鈣溶液至不再產生沉淀,產生沉淀的質量與加入氯化鈣溶液的質量關系如圖所示查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com