
非金屬元素
考點聚焦
1.理解非金屬的概念。
2.了解元素原子核外電子排布的周期性與元素性質遞變關系。重點掌握典型非金屬( 鹵族元素)在周期表中的位置及與其性質的關系。了解其他常見非金屬元素(如:H、O、S 、N、P、C、Si)的單質及其化合物。
知識梳理
一、非金屬元素在周期表中的位置和原子結構特點:
1.位置:在已知的元素中,非金屬共22種(包括6種稀有氣體元素),除氫元素位于周期表的ⅠA族外,其余都集中在元素周期表階梯線(硼、硅、砷、碲、砹斜線)的右上方。
2。原子結構特點及化合價:
Ⅰ.最外層電子均大于、等于3(除H以外),與其主族序數相同。
Ⅱ.最高正價分別為:+4 +5 +6 +7(與族序數相等)
對應最低負價:-
Ⅲ.非金屬元素一般都有變價:除呈現上述最高價及最低價以外,有的非金屬還呈現其它價態。如:
S:+4價;N:+1 +2 +3 +4價; Cl:+1 +3 +5價。
3.非金屬單質的聚集狀態和同素異形體:
①典型的非金屬單質在固態時為分子晶體,如:F2、Cl2、Br2、I2、O2、S、N2、P4、H2,這些晶體表現為硬度不大,熔點不高,易揮發、不導電,它們在常溫下聚集態為氣態(“氣”字頭)液態(“氵”旁)或固態(“石”字旁)
②碳(金剛石)、硅、硼為原子晶體,硬度很大,熔沸點很高。由于原子晶體中沒有離子和自由電子,所以固態和熔融態都不導電。但某些原子晶體,如單晶硅可以作為半導體材料。
③非金屬元素常出現同素異形現象。如:金剛石與石墨;白磷與紅磷;O2與O3;S2、S4、S8等互為同分異構體。
二、元素非金屬性的強弱規律
1.常見非金屬元素的非金屬性由強到弱的順序: F、O、Cl、N、Br、I、S、P、C、Si 、H
2.元素的非金屬性與非金屬單質活潑性是并不完全一致的:如元素的非金屬性O>Cl, N>Br;而單質的活潑性:O2 <Cl2,N2<Br2。但由于某些非金屬單質是雙原子分子,原子間以強烈的共價鍵相結合(如N N等),
當參加化學反應時,必須消耗很大的能量才能形成原子,表現出了單質的穩定性。這種現象不一定說明這種元素的非金屬性弱。強的分子內共價鍵恰是非金屬性強的一種表現。
3.比較非金屬性強弱的八條依據
(1)元素在周期表中的相對位置
①同周期元素,自左向右,元素的非金屬性依次增強,如F>O>N>C>B;Cl>S>P>S i等。
②同主族元素自上而下,非金屬性依次減弱,如F>Cl>Br>I;O>S>Se;N>P>As等 。
(2)非金屬單質與氫氣化合的越容易,非金屬性越強。如F2、Cl2、Br2、I2 與H2化合由易到難,所以,非金屬性F>Cl>Br>I。
(3)氣態氫化物的越穩定,非金屬性越強,如穩定性HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金屬性F>O>Cl>N>Br>I>S>P。
(4)最高價氧化物對應的水化物的酸性越強,非金屬性越強,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,則非金屬性Cl>S>P>C>Si。
(5)非金屬性強的元素的單質能置換出非金屬性弱的元素的單質。如
(6)非金屬單質對應陰離子的還原性越強,該非金屬元素的非金屬性越弱。常見陰離子的還原性由強到弱的順序是S2->I->Br->Cl->F-,則非金屬性S<I<Br<Cl<F。
(7)與變價金屬反應時,金屬所呈價態越高,非金屬性越強,如Cu+Cl2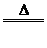 CuCl2;2Cu+S
CuCl2;2Cu+S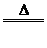 Cu2S,說明非金屬性Cl>S。
Cu2S,說明非金屬性Cl>S。
(8)幾種非金屬同處于一種物質中,可用其化合價判斷非金屬性的強弱,如HClO、HClO3中,氯元素顯正價、氧元素顯負價,說明氧的非金屬性強于氯。
三、非金屬元素的化學性質(注意反應條件、現象、生成物的聚集狀態)
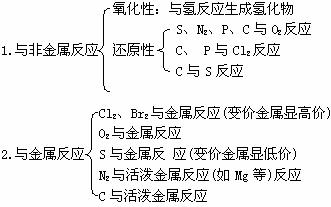


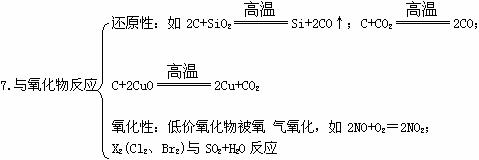
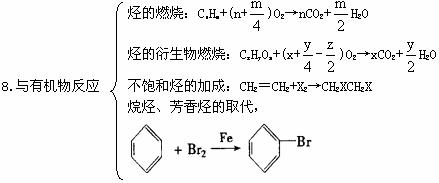
四、常見非全屬單質的制取方法
1.電解法
①電解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②電解熔融物:如2KHF F2↑+H2↑+2KF
F2↑+H2↑+2KF
2.分解法:如2KClO3 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4 C+2H2 2H2O2
C+2H2 2H2O2 2H2O+O2↑
2H2O+O2↑
3.置換法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足) 2H2O+2S
2H2O+2S
4.氧化法:如MnO2+4HCl(濃)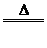 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O
2H2S+SO2=3S+2H2O
5.還原法:C+H2O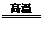 CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2
CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2 Si+2CO↑
Si+2CO↑
試題枚舉
【例1】 (1)氰化鉀、氰化氫的制備反應式為:K2CO3+C+2NH3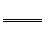 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3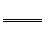 HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
氰離子為負一價(CN-),其中碳氮元素的化合價分別為________。 以上兩個反應是否均為氧化還原反應?(2)制備純凈無水HCN(沸點299K)的另一種方法是 :混合磨細的KCN和KHS粉末適度加熱①試寫出這個反應式。②為什么要磨細和用粉末?③為什么要強調適度加熱?
解析:據共價鍵理論,一般當碳同非金屬性比它強的元素結合時,碳顯正價,氮為負價,為-3價,所以(CN-)中碳為+2價,氮為-3價。故①為氧化還原反應,②為非氧化 還原反應。第二種方法制備HCN是固體與固體之間的反應,故磨細和用粉末的目的是增大表面積,加快反應速率,據題意知,第二種方法制備HCN如溫度太低,反應速率較小,溫度太高,則酸式鹽易分解發生副反應:2KHS
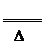 K2S+H2S↑。該反應的化學方程式為KCN+KHS
K2S+H2S↑。該反應的化學方程式為KCN+KHS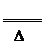 HCN↑+K2S。
HCN↑+K2S。
【例2】 金屬M可以在不同條件下發生下列五個反應:M+A→I M+B→H M+C→H+F M+D→H+A M+E→I+G 其中(1)A、B、C、D、E在通常情況下都是氣體,并且C是CO 2。(2)上述反應的產物,在不同條件下,還可和有關反應物發生下列反應:F+B→C A +G→E,(3)I是一種離子化合物,它可以水解產生一種白色沉淀和E。該白色沉淀加熱可 分解為H和H2O。而E則是分子晶體,其分子中共有10個電子,根據以上條件,判斷并寫出 有關物質的化學式:A________,B________,C________,D________,E________,F________,G________,H________,I________,M________。
解析: 本題的突破口是M+C→H+F,而C為CO2。一般同CO2能發生反應的金屬就現有知識來講,只能是Mg。F、H中有一為碳,根據F+B→C,則C為CO2,B為氣體,F肯定為碳,H為MgO。掃描全題,得知E是分子晶體,且其分子中共有10個電子。分子中有10個電子的有:HF、H2O、NH3、CH4等。而E又通過一種離子化合物水解而得到,E可能為 HF或NH3。如E為HF,根據M+E→I+G,HF同Mg作用,但事實HF同Mg不反應。如為NH3同樣根據A+G→E,A為N2或H2。因為Mg可跟A作用,顯然A為N2,I為Mg3N2。再根據M+D→H+A,M為Mg,H為MgO,A為N2,則D只能為NO2。
答案:A:N2,B:O2,C:CO2,D:NO2,E:NH3,F:C,G:H2,H:MgO,I:Mg 3N2,M:Mg。
硫及其化合物
考點聚焦
1.硫的物理性質及硫的可燃性。
2.了解二氧化硫與氧氣、與水的反應及二氧化硫的實驗室制法,認識亞硫酸的不穩定性,認識二氧化硫的漂白作用與次氯酸的漂白作用的區別。
3.知道濃硫酸的強氧化性。
4.學會SO42-的檢驗方法硫的幾種常見價態之間的相互轉化硫。
知識梳理
硫位于周期表 周期 族。淡黃色晶體,難溶于水,微溶于酒精,能溶于 。
二、硫的化學性質-
1.硫的可燃性:硫在純凈的氧氣中燃燒現象 ,硫的化合價- (填“升高或降低”)
2.汞與硫磺生成硫化汞,因此,實驗室常將硫磺撒在汞的表面,以除去不慎灑落的汞。化學方程式為 ,硫的的化合價 (填“升高或降低”)
3.硫與氫氣化合生成 ,生成的氫化物比水 (“穩定”還是“不穩定”)
三、SO2
1.SO2的物理性質: 色有 氣味 體, 毒 溶于水。
2.SO2的化學性質:(1)具有酸性氧化物的通性:
(2)具有還原性:
(3)具有氧化性 其氧化性比氧氣,氯氣都弱。
(4)具有漂白性:漂白原理是 和HClO的漂白性的區別 。
★幾種物質漂白原理的比較
SO2
氯水、H2O2、Na2O2、O3
活性炭
漂白原理
與有色物質結合生成無色物質
將有色物質氧化為無色物質
吸附有色物質
變化類型
化學變化
化學變化
物理變化
是否可逆
可逆,加熱或日久后恢復原來顏色
不可逆,加熱或日久后不恢復原來顏色
3. SO2的實驗室制法:
反應原理
Na2SO3+ H2SO4== Na2SO4+ SO2↑+H2O(可加熱提高反應速率)
Cu+ 2H2SO4
(濃) 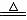 CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O
發生裝置
固體與液體反應制取氣體,發生裝置與制Cl2相似
收集方法
向上排空氣法
干燥
用濃H2SO4或P2O5酸性干燥劑(不可用堿石灰)
尾氣處理
用NaOH等堿溶液吸收多余的二氧化硫氣體
4.SO2的危害和治理
SO2是大氣主要污染物,直接危害人類身體健康,酸雨為SO2產生的二次污染物。SO2的主要來源為燃燒含硫的燃料(如煤),消除SO2污染的最有效的途徑是減少SO2的排放。
SO3是硫的最高價氧化物,為白色易揮發晶體,是典型的酸性氧化物
四、硫酸
濃硫酸除了具有酸的通性外,還具有吸水性、脫水性和強氧化性這三大特性。
(1) 吸水性:吸收游離的水。可作實驗室的干燥劑(但不能干燥堿性氣體和還原性氣體)。
(2) 脫水性:把有機物中的氫、氧兩種元素按水的比例脫去。如蔗糖中加入濃硫酸(注意吸水和脫水的區別)。
(3) 強氧化性:濃硫酸的強氧化性還可以與多種物質反應體現。
2H2SO4(濃)+Cu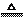 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
2H2SO4(濃)+C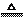 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
在常溫下,濃硫酸跟鐵、鋁接觸時,能在金屬表面生成一薄層致密的氧化物,從而阻止內部的金屬繼續反應,這種現象叫鈍化。因此可以用鐵或鋁貯存濃硫酸(硝酸也具有這一性質)。但是加熱條件下可以反應。注意:常溫下鐵、鋁使濃硫酸、濃硝酸鈍化(鈍化過程是復雜的化學變化),不能理解成“常溫下鐵、鋁使濃硫酸、濃硝酸不發生化學反應”。
五、SO42-檢驗
被檢液中滴入少量 酸化,再加入 ,若產生 ,不可用硝酸酸化,原因是 。
試題枚舉
【例1】高溫下硫酸亞鐵發生如下反應:2FeSO4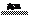 Fe2O3+SO2↑+SO3↑若將生成的氣體通入氯化鋇溶液中,得到的沉淀是 ( )
Fe2O3+SO2↑+SO3↑若將生成的氣體通入氯化鋇溶液中,得到的沉淀是 ( )
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
解析:SO2和SO3通入氯化鋇溶液,只有硫酸鋇沉淀,因為亞硫酸鋇溶于稀硫酸
答案:D
【例2】白色的亞銅化合的Cu(NH4)SO3難溶于水,若與足量的10mol?L-1的硫酸溶
液混合并微熱,生成銅和SO2氣體及溶液。
(1)完成并配平化學方程式:Cu(NH4)SO3+H2SO4-Cu+SO2+CuSO4+_________
(2)按上述操作,銅的最高轉化率是多少_______________
(3)有人設計讓上述實驗在密閉容器中進行,結果銅的轉化率大大提高,問在密閉
容器中進行反應,銅的最高轉化率是多少?請說明理由。
解析:(1)上述反應打用逆向配平(歧化反應,銅元素化合價既升高又降低)缺項顯然為(NH4)2SO4 ,各計量系數依次為2,2,1,2,1,2,1。
(2)2molCu (NH4)SO3中的銅1mol轉化為單質銅,1mol轉化為CuSO4,因此,轉化率為50%。
(3)若在密閉容器中進行,為何銅的轉化率會提高?顯然Cu(I)自身岐化轉化率只能為50%,必有其它還原劑才能提高其轉化率。由于產物中含SO2,SO2具有強還原性,能將Cu(II)還原為零價。其最高轉化率可達100%,原因是:每生成1molCuSO4可生成2molSO2,它可提供4mol電子,完全可將CuSO4還原且SO2仍過量。
答案:(1) 2,2,1,2,1,2,1 (2) 50% (3)略
【例3】硫與熱強堿溶液可生成S2-和SO32-;生成物繼續與硫作用得Sz2-和S2O32-。過濾后除去過量硫,向濾液中加入一定量的強堿后,再適入足量的SO2,SO2與Sz2-也完全轉化為S2O32-。問:
(1)S+SO2+OH-完全轉化為S2O32-的離子方程式____________________
(2)amolS最終轉化為Na2S2O3,需SO2、NaOH的物質的量分別為________
(3)若amolS最終轉化為Na2Sz耗原熱堿溶液6molNaOH,則Na2Sx中x值為
_________。
 解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①
解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①

 S2-+(x+1)S Sx2- ………………②
S2-+(x+1)S Sx2- ………………②
SO32-+S △ S2O32- ……………………③
由①②③迭加得:(2x+2)S+6OH- = 2Sx2-+S2O32-+3H2O …………④
SO2+Sx2-+OH-――S2O32-+H2O ………………⑤
由④⑤迭加得:S+SO2+2OH-=S2O32-+H2O …………………………⑥
答第(1)問時,實質不必要這么繁的過程,因Sx2-、SO32-均為中間產物,只要抓住反應物為S和SO2及OH-,生成物為S2O32-和水即可得反應⑥。
由⑥式可知每有1mol硫需1molSO2和2molOH-,則SO2和OH-分別為a、2amol。
(3)由④式可知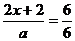 x=
x=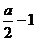
答案:(1) S+SO2+2OH-=S2O32-+H2O (2) a、2amol (3) 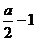
氯及其化合物
考點聚焦
1.知道氯氣的物理性質。
2.了解氯氣及其化合物的性質
3.知道氯水的消毒和漂白原理
4.學會Cl-的檢驗方法
5.理解鹵族元素原子結構及其單質性質的遞變性
知識梳理
一、 氯元素的原子結構與自然界的存在
氯元素位于周期表__周期__族,在自然界中的主要存在形態: 。全球海洋中含鹽 左右,主要為 、 。
二、 活潑的氯氣
1、氯氣的物理性質: 色有 氣味的 體, 毒, 溶于水。實驗室中應怎樣聞氣體: 。
2、氯氣的化學性質
由氯的原子結構示意圖可知氯元素的性質如何?進而能否預測氯氣的化學性質又怎樣?為什么? 。
① 與金屬單質的反應:與鈉反應方程式 。現象是 。與
鐵反應方程式 。現象是 。與銅反應方程式 。現象是 。
② 與氫氣的反應:化學方程式: ,反應現象:氫氣在氯氣中燃燒 ;氯氣與氫氣的爆炸實驗 。
③Cl2 和紅磷反應:化學方程式: ,反應現象 。
結論:分析以上反應中氯元素價態的變化也可得知:氯氣是一種強氧化性物質,常氧化劑。
思考:在初中我們是如何定義燃燒的?現在通過氫氣與氯氣的燃燒實驗,你有什么新的認識?
④與水的反應:
與水反應的離子方程式: ,說明:氯氣與水反應很微弱,且未可逆反應。
思考:1、氯水的成分 ?(氯水參加反應時,能表現多種性質)2、氯水的保存方法?
⑤次氯酸的性質:
a、一元弱酸(比 弱)
b、強氧化性( 、 、 )
c、不穩定(見光或受熱分解):化學方程式: 。
⑥與堿的反應
Cl2 + _NaOH -- 。(常用于除去多余氯氣)
離子方程式: 。漂白液主要成分是 。
漂白粉的制法: 。其主要成分: ,有效成分: 。漂粉精的有效成分: 。
漂白原理:ClO-+ H+ = HClO(實際漂白者),Ca(ClO)2 +_HCl(稀)= 。
Ca(ClO)2 +CO2 +H2O = 。
思考:抗洪救災中防疫部門,向災民發放的漂白粉片或漂粉精用于飲用水消毒。漂粉精為何要密封保存在陰暗處?
三、 氯離子的檢驗
1、填寫下列表格:
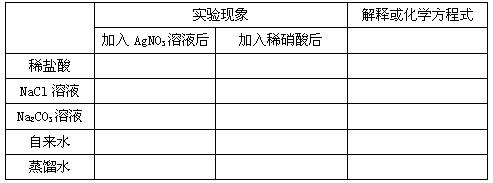
2、原理:被檢液中滴入少量 酸化,再滴入 溶液,若產生 ,則可斷定溶液中含有氯離子。不可用鹽酸酸化,酸化目的是防止( 、 、 、 )影響。
+ AgNO3(aq) → + 稀硝酸 →白色↓
解釋:Ag+ + Cl― = AgCl↓
2Ag+ + CO32― = Ag2CO3↓ Ag2CO3 + 2H+ = 2Ag+ + H2O + CO2↑
四、鹵族元素
(一)鹵素的原子結構
不同點:核電荷數逐漸 ;電子層數逐漸 ;原子半徑依次 ,得電子能力逐漸 ;單質氧化性逐漸 。
隨鹵素核電荷數增加,其原子結構的遞變而使鹵素單質的物理性質呈規律性變化.
歸納:從F2 →I2
1、顏色逐漸 ,狀態從 → → ,密度從 → ,熔沸點由 → (原因是 。
2、單質的溶解性――除氟外(與水劇烈反應)在水中溶解度都較 ,且由 → ,都易溶于有機溶劑,下表列出Cl2、Br2、I2在不同溶劑中的顏色.
水
CCl4
Cl2
Br2
I2
(三)鹵素單質的化學性質(相似性及遞變性)
由于最外層均為 個電子,極易 電子,因此鹵素都是 劑,在自然界均只以 態存在.但隨著電子層數遞增,原子半徑漸 ,核對外層電子的引力漸 ,得電子能力漸 ,其氧化性逐漸 ,主要表現:
。
試題枚舉
【例1】下列有關氯的敘述中正確的是
A.液氯和氯水是同一物質
B.紅磷在氯氣中燃燒產生白色煙霧
C.氯氣與水的反應中氯是氧化劑,水是還原劑
D.用氯制漂白粉是為了得到易貯存的漂白劑
解析:液氯、氯水都是液體,但前者是純氯,后者是氯與水的混合物,時間延長氯水中還逐漸生成鹽酸和次氯酸,氯分子漸少,氯離子漸多。如果再有光照, 因分解也在漸少,出現氧氣和更多鹽酸。氯與水的反應是氯分子中氯原子間發生的自身氧化還原,即歧化反應, 水雖然是反應物,卻未參加氧化還原。A、C不正確。
煙是分散在氣體中的固體小顆粒,霧是分散在氣體里的液體小珠滴。磷在氯氣里燃燒的產物三氯化磷是無色液體,可發霧;五氯化磷是淺黃色固體,能形成煙。漂白粉和氯都可以作為漂白劑、消毒劑,且氯更有效。但氯氣難貯存,又有劇毒,一般醫用、家用的漂白劑和消毒劑使氯氣是不合宜的,所以制成漂白粉便于貯存和使用。漂白粉保存得當,如密閉,以防止吸水和 而變質,可以存放較長時間。B、D正確。
答案:B、D。
【例2】 潮濕的氯氣、新制的氯水、次氯酸鈉及漂白粉的水溶液均能使有色布條褪色,原因是它們均含有 ( )
A. 氯氣 B. 次氯酸 C. 次氯酸根 D. 氯化氫
解析 NaClO及Ca(ClO)2的水溶液中,ClO―水解產生HClO無HCl;有色布條的褪色是因HClO的氧化所致。
答案: B
【變式】 用滴管將新制的氯水慢慢滴入盛酚酞的氫氧化鈉稀溶液中,當滴到最后一滴時紅色突然褪去,發生這一現象的原因可能有兩個:
①是由于 (用簡要文字說明)
②是由于 (用簡要文字說明)
簡述用實驗方法證明褪色的原因是①還是②
。
【例3】如何鑒別NaCl、NaBr、KI三種白色固體?
解答:
方法一:可用氯水鑒別。
把這三種物質各取少量制成溶液,加入新制的氯水和汽油(或四氯化碳),振蕩,分層,使汽油層呈無色的是NaCl;使汽油層呈橙色的是NaBr;呈紫色的是KI。
方法二:可先用焰色反應將KI區分出來。然后再將另外兩種物質各取少量制成溶液,加入AgNO3溶液,有白色沉淀生成的是NaCl,有淺黃色沉淀生成的是NaBr。
方法三:直接加入AgNO3溶液。
分別取少量固體制成溶液,分別加入AgNO3溶液,有白色沉淀生成的是NaCl,有淺黃色沉淀生成的是NaBr,有黃色沉淀生成的是KI。
【例4】 多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性質與鹵素單質相似,故稱它們為擬鹵素。它們可以生成酸和鹽(見下表,表中X代表F、Cl、Br或I)。
鹵素
氰
硫氰
①
“單質”
X2
(CN)2
(SCN)2
(OCN)2
酸
HX
HCN
②
HOCN
鹽
KX
KCN
KSCN
③
(1)在表中①②③空格處應分別填寫_______、_______、_______。
(2)完成下列反應的化學方程式或離子方程式。
①(CN)2和KOH溶液反應的化學方程式為:______________。
②已知陰離子的還原性強弱為:Cl-<Br-<CN-<SCN-<I-。試寫出在NaBr和KSCN的混合溶液中加入(CN)2反應的離子方程式:____________________________________。
解析:此題主要考查“運用已學知識進行類推思維的能力”。解題時可用熟知的Cl2、HCl、KCl等物質作參照物。由還原性Br―<CN―<SCN―,可推知氧化性Br2>(CN)2>(SCN)2,因而可判斷(CN)2只能與KSCN反應,不能與NaBr反應,亦即由物質的氧化性和還原性的強弱,可以判斷氧化還原反應能否發生。
答案:(1)氧氰 HSCN KOCN
(2)①(CN)2+2KOH====KCN+KOCN+H2O
②(CN)2+2SCN-====2CN-+(SCN)2
該題為信息給予題,給予的信息是:擬鹵素〔如(CN)2〕的性質與鹵素單質相似,由此而可依據鹵素單質的性質來進行類比、模擬來解答習題。這是解答信息給予題的一種方法。
【變式】 溴化碘(IBr)的化學性質與鹵素單質相似,能與大多數金屬反應生成金屬鹵化物,和某些非金屬單質反應生成相應的鹵化物,跟水反應的方程式IBr+H2O=HBr+HIO,下列有關IBr的敘述中,不正確的是 ( )
A. IBr是雙原子分子
B.在很多反應中IBr是強氧化劑
C.和NaOH溶液反應生成NaBr和NaIO
D.和水反應時,既是氧化劑又是還原劑
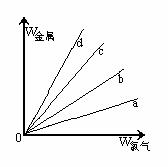 【例5】在右圖的四條直線分別表示鈉、鎂、鋁、鐵與足量Cl2反應時,消耗金屬的質量(縱軸)與反應掉的氯氣質量(橫軸)的關系,其中代表鐵與Cl2反應的直線是 ( )
【例5】在右圖的四條直線分別表示鈉、鎂、鋁、鐵與足量Cl2反應時,消耗金屬的質量(縱軸)與反應掉的氯氣質量(橫軸)的關系,其中代表鐵與Cl2反應的直線是 ( )
A. a B. b C. c D. d
解析 Cl2與四種金屬反應的均為氧化還原反應,在橫坐標上取一點作一條垂直于橫坐標的直線,分別與a、b、c、d四條直線的交點即為四種金屬與等質量Cl2反應時所需的質量。假設這一點的質量為35.5g,此時金屬均轉移1mol電子,則消耗四種金屬的質量分別為:WNa=23g、WMg=12g、WAl=9g、WFe=18.7g,即等質量氯氣消耗四種金屬的質量是WNa>WFe>WMg>WAl,故a、b、c、d分別代表Al、Mg、Fe、Na與氯氣的反應。
答案:C
氮及其化合物
考點聚焦
1. 知道氮氣的物理性質及存在。
2. 能從氮氣的結構理解其化學性質。
3. 掌握氮氧化物的重要性質,知道氨的物理性質和用途,掌握氨與水、HCl、O2等的反應。了解氨水的成分及不穩定性。
4. 了解銨鹽易溶于水、受熱易分解、與堿反應。知道NH4+的檢驗方法。
5. 掌握氨氣的實驗室制法。
6. 了解硝酸的化學性質。
知識梳理
一、氮氣
1.氮氣的結構和物理性質:氮氣在空氣中約占總體積的 。氮氣是無色無味的氣體,難溶于水。氮氣的電子式 ,結構式為 。氮氣的化學性質不活潑,其原因是 。所以氮氣可做保護氣。但在一定條件下,可與氫氣、氧氣反應,方程式 。
2.自然界的固氮是把 態的氮轉化為 態的氮,如把 轉化為一氧化氮。方程式 。
二、氮的氧化物
氣體
性質
NO
NO2
狀 態
氣體
氣體
顏 色
無色
紅棕色
氣 味
無味
刺激性氣味
水溶性
不溶
與水反應
實驗室制法與收 集
Cu + HNO3(稀)
因會與O2反應,只能排水法收集
Cu+HNO3(濃)
因會與水反應,只能排氣法收集
關 系
都是有毒氣體,會造成環境污染;會與碳氫化合物作用形成光化學煙霧,也會形成酸雨
三、氨氣
1.氨氣是 色 氣味的氣體, 液化, 溶于水。電子式是 ,它的空間構型是 ,是 性分子。
2.氨氣是 色有 氣味的氣體,密度比空氣小,易液化,所以常用作制冷劑。極易溶于水。常溫常壓下,1體積的水能溶解700體積的氨氣。(用噴泉實驗證明,噴泉實驗成功的關鍵,想一想還有哪些氣體能做噴泉實驗?)
3.氨氣的化學性質:
(1)與水的反應:
思考:氨水和液氨在微粒的組成、性質上有何區別。
(2)與酸的反應:離子方程式為 。
氨水易揮發,不易運輸,因此常將其轉化為各種固態銨鹽加以使用。
4.氨氣的實驗室制法:
(1)原理:
(2)收集方法: (3)干燥方法:
(4)驗滿方法 (5)尾氣處理:
思考:哪些氣體最后要進行尾氣處理。
四、銨鹽
1.結構: (電子式)
1. 物理性質:都是離子晶體,都易溶于水。
2. 化學性質:(1)受熱分解:NH4Cl
NH4HCO3
銨鹽的受熱分解比較復雜,并非都生成對應的酸和氨氣。
(2)與堿的反應:
思考:NH4+的檢驗:操作為
離子方程式為
五、硝酸
濃、稀硝酸均為強氧化性酸,與金屬反應均不產生氫氣,但濃硝酸的氧化性更強,濃硝酸一般被還原成NO2,稀硝酸一般被還原成NO;濃硝酸具有揮發性、不穩定性,遇金屬鐵、鋁產生鈍化現象;因此保存時要把它盛放在棕色瓶里,儲存在陰暗而且溫度低的地方。
練習:寫出下列化學方程式:
1. 硝酸的不穩定性:
2. 銅與濃硝酸的反應:
3. C與濃硝酸的反應:
4. 與苯的反應:
☆三大強酸的對比
硝酸
硫酸
鹽酸
重要物理性質
純凈硝酸為無色液體,常見濃硝酸因溶有分解產生的NO2 而呈黃色,易揮發。能以任意比與水混溶
無色油狀液體,難揮發。能以任意比與水混溶
純凈鹽酸為無色液體,常見鹽酸含有工業雜質(Fe3+)而呈黃色
重要化學性質
強酸性;不穩定性,受熱見光易分解;濃稀硝酸均有強氧化性
強酸性;稀硫酸只表現酸性,濃硫酸既表現酸性又表現吸水性、脫水性、強氧化性
強酸性;還原性(濃度越大還原性越強)
實驗室制法
硝酸鈉與濃硫酸微熱
氯化鈉與濃硫酸強熱
工業制法
NH3 ~NO~NO2 ~HNO3 注:NO循環氧化吸收
FeS2~2SO2 ~2SO3 ~2H2SO4
注:SO2 循環氧化吸收
H2 在Cl2 中燃燒生成的HCl 用水吸收
☆關于濃酸變稀的問題
從上表中可看出三大強酸有一個共同的特點――濃度不同時所表現的性質有所不同,記住此點會給我們解題帶來重要突破。記住下列反應:
4HNO3(濃) + Cu = Cu(NO3)2 + 2NO2 ↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
2H2SO4(濃)+ Zn = ZnSO4 + SO2 ↑+2H2O
H2SO4(稀) + Zn = ZnSO4 + H2 ↑
 4HCl (濃 + MnO2
MnCl2 +Cl2
↑+2H2O
4HCl (濃 + MnO2
MnCl2 +Cl2
↑+2H2O
試題枚舉
【例1】Murad等三位教授提出NO在人體內有獨特的功能,關于NO的敘述正確的是
①NO可以是某些含低價氮物質氧化的產物
②NO不是亞硝酸酐
③NO可以是某些含高價氮物質還原的產物
④NO是無色氣體
A.全部 B.①③④
C.②③④ D.①④
解析:NO中氮的化合價處于中間價態,它可以是還原產物,如HNO3→NO,也可以是氧化產物,如NH3→NO;HNO2的酸酐是N2O3;NO是無色氣體。所以,所給的幾種說法都正確。
答案: A
【例2】“搖搖冰”是一種即用冷的飲料,吸食時將飲料罐隔離層中的化學物質和水混合后搖動即會致冷。該化學物質是
A NaCl B NH4NO3(s) C NaOH(s) D CaO(s)
解析:溶解過程中伴隨著能量的變化,固體硝酸銨溶于水吸熱,使溫度降低,固體氫氧化鈉溶于水放熱,使溶液溫度升高,生石灰與水的反應也放出大量的熱,氯化鈉溶解過程中能量的變化很小。
答案:B
【例3】同溫同壓下,在3支相同體積的試管中分別充有等體積的2種氣體,它們是(1)NO和NO2(2)NO2和O2(3)NH3和N2。現將3支試管均倒置于水槽中,充分反應后剩余氣體的體積分別是V1、V2、V3,則下列關系正確的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V3>V1>V2
解析:設每種氣體的體積為1體積,則:(1)中剩余1+(1/3)=4/3體積氣體;(2)中剩余3/4體積的氧氣;(3)中剩余1體積的N2.
答案:B
在進行氮氧化物計算時,要注意有關循環氧化、由多步反應合并所得總反應的應用。記注下列反應:
4NO2 + O2 + 2H2O = 4HNO3 4NO +3O2 + 2H2O = 4HNO3
NO2 + NO + 2NaOH = 2NaNO2 + H2O 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
【變式】在一定溫度和壓強下,將裝有N2和NO2混合氣體的試管倒立于水中,足夠時間后,試管內氣體體積縮小為原來體積的3/5,則遠混合氣體中N2和NO2的體積比
A.2:3 B.3:2 C.3:5 D.5:3
答案:A
碳、硅及其化合物
考點聚焦
1. 掌握C、CO、CO2的重要性質以及實驗室制取、檢驗CO2方法。
2. 知道 硅在自然界中的存在形態,主要用途。
3. 能利用晶體結構理論來解釋硅和二氧化硅的物理性質,了解它們的化學性質。
4. 了解陶瓷、玻璃、水泥等硅酸鹽產品的用途。
知識梳理
一、硅(Si)
1.硅的存在:在自然界只有化合態,是一種親氧元素(這與同主族的碳不同),一般以SiO2 或 的形式存在,在地殼中的含量僅次于氧。
2.結構:與金剛石的晶體結構類似,是正四面體型空間網狀結構的原子晶體。
3.物理性質:灰黑色,硬度大,熔沸點高,具有金屬光澤。
4.化學性質:常溫下與F2、HF、NaOH反應:
加熱時能與H2化合生成不穩定的氫化物。
5.用途:(1)良好的半導體材料(為什么?)
(2)太陽能電池
(3)計算機芯片
二、二氧化硅(SiO2)
1.存在:天然SiO2也叫硅石,自然界中的石英瑪瑙(含雜質的石英)的主要成分都是SiO2。。
2.結構:一個硅原子與4個氧原子形成4個共價鍵,即每個硅原子周圍有4個氧原子,每個氧原子周圍有2個硅原子;晶體中硅原子和氧原子以1:2組成空間立體網狀結構,是原子晶體。
3.化學性質:(1)酸性氧化物:與強堿反應:
離子方程式: (保存堿性溶液不能用橡膠塞)。與堿性氧化物反應: 。
(2)與HF反應: (唯一與其反應的酸)。
4,用途:(1)制造光導纖維
(2)石英坩堝
(3)光學儀器和工藝品
三、硅膠
1. 制法: 。
2. 性質: 。
試題枚舉
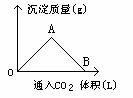 【例1】右圖為一定量飽和Ca(OH)2溶液中通入CO2氣體后,產生CaCO3白色沉淀的質量與CO2體積的關系曲線,試回答:
【例1】右圖為一定量飽和Ca(OH)2溶液中通入CO2氣體后,產生CaCO3白色沉淀的質量與CO2體積的關系曲線,試回答:
(1)OA段曲線與AB段曲線所表示的反應方程式為OA:__________,AB_____________。
(2)A點已參加反應的CO2和Ca(OH)2的物質的量之比為______________。
(3)B處溶液中存在的濃度較大的兩種離子是_______和________(填離子符號),將B處生成的溶液煮沸可見到的現象是_______________
解析:CO2與Ca(OH)2反應,CO2的量直接影響產物的生成,圖形較清楚地反映了這一關系,依據有關反應原理:
CO2(少)+Ca(OH)2== CaCO3↓+H2O ,
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
便可判斷圖形中各段所發生的反應,OA段隨著CO2繼續通入CaCO3的量逐漸增大,A點達到沉淀最大值,AB段隨CO2的繼續通入,生成的CaCO3不斷溶解轉化為Ca(HCO3)2,B點CaCO3全溶解,溶液又變得澄清。
答案:(1)OA段:CO2+Ca(OH)2== CaCO3↓+H
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
(2)A點:n(CO2)∶n[Ca(OH)2]=1∶1
(3)Ca2+ HCO3- 因Ca(HCO3)2受熱分解,溶液變渾濁,有氣泡逸出。
【例2】下列關于硅的說法不正確的是 ( )
A.硅是非金屬元素,但它的單質是灰黑色有金屬光澤的固體
D.硅的導電性能介于金屬和絕緣體之間,是良好的半導體材料
C硅的化學性質不活潑,常溫下不與任何物質起反應
D.當加熱到一定溫度時,硅能與氧氣、氫氣等非金屬反應
解析: 常溫下,硅可與氟氣、氫氟酸、強堿溶液反應,加熱和高溫條件下,硅能與氧氣、氫氣起反應。選C。
答案: C
【例3】石墨炸彈爆炸時能在方圓幾百米范圍內撒下大量石墨纖維,造成輸電線、電廠設備破壞。這是由于石墨( )
A . 有放射性 B. 易燃、易爆 C. 能導電 D. 有劇毒
解析:利用了石墨的導電性能,石墨纖維落在輸電線上,造成線路短路,發電機和其他設施損壞。石墨性質穩定,無毒也不易燃、易爆。
答案: C
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com