
題目列表(包括答案和解析)
某化學興趣小組的同學為進行物質性質的探究,用維持燒瓶內壓強與分液漏斗內壓強相等,使液體能順利滴下
下圖所示裝置進行實驗。請回答下列問題:(加熱及固定裝置已略去)

(1)裝置A中反應的化學方程式為
(2)裝置C 中的試劑是 ( 填序號).
A.氫氧化鈉溶液 B. 酸性高錳酸鉀溶液 C.亞硫酸氫鈉溶液
發生反應的離子方程式為 ,其說明了SO2具有 ,該實驗操作的名稱是 。
(3)在上述實驗中,能說明碳的非金屬性比硅強的實驗現象是
(4)B中的溶液無明顯現象,當滴加氯水時有白色沉淀,寫出SO2表現還原性并生成白色沉淀的總離子方程式為
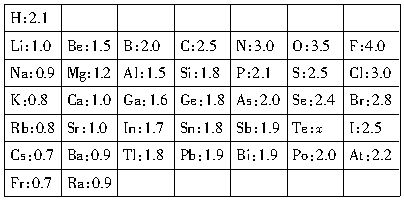
H:0.1 |
|
|
|
|
|
|
Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.5 |
Fr:0.7 | Ra:0.9 |
|
|
|
|
|
回答下列問題:
(1)寫出上述元素電負性在同周期或同主族中的遞變規律(任定一種):___________________。
(2)預測Te元素χ的值為_________,它的非金屬性比I元素_________ (選填“強”或“弱”)。
(3)你認為Linus Pauling提出電負性的概念是確定化合物中原子_________(選填“失電子”或“得電子”)能力的相對大小。
(4)大量事實表明,當兩種元素的Χ值相差大于或等于1.7時,形成的化合物一般是離子化
合物,根據此經驗規律,AlCl3中化學鍵的類型應該是_________。
 如圖是元素周期表的一部分,X、Y、Z、W均為短周期元素,X、Z的質子數之和為21.下列說法正確的是( )
如圖是元素周期表的一部分,X、Y、Z、W均為短周期元素,X、Z的質子數之和為21.下列說法正確的是( )
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com