
科目: 來源: 題型:選擇題
| A. | 若單位時間生成xmolNO的同時,消耗1.5xmolH2O,則反應達到平衡狀態 | |
| B. | 達到平衡狀態后,NH3、O2、NO、H2O(g)的物質的量之比為4:5:4:6 | |
| C. | 達到平衡狀態時,若增加容器體積,則反應速率增大 | |
| D. | 達到平衡時,5v正(O2)=4v逆(NO) |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:實驗題
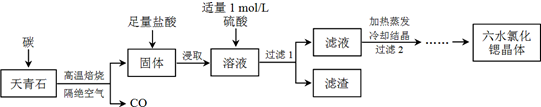
查看答案和解析>>
科目: 來源: 題型:實驗題

查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
查看答案和解析>>
科目: 來源: 題型:實驗題
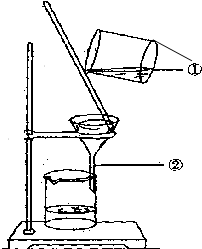 如圖為某學生進行粗鹽提純實驗中過濾操作的示意圖,試回答:
如圖為某學生進行粗鹽提純實驗中過濾操作的示意圖,試回答:查看答案和解析>>
科目: 來源: 題型:實驗題

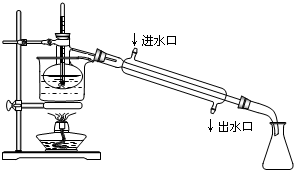
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都隨溫度的升高而增大 | |
| B. | 結構式為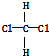 和 和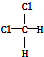 的物質互為同分異構體 的物質互為同分異構體 | |
| C. | 根據反應:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的強弱的順序為:H2CO3>HA>HCO3->HB | |
| D. | 過硼酸鈉晶體(NaBO3•4H2O)是一種優良的漂白劑,在70℃以上加熱該晶體30.80克,反應后稱量固體質量為27.20克,則該固體物質的化學式為NaBO3•H2O |
查看答案和解析>>
科目: 來源: 題型:實驗題
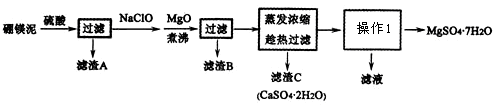
查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com